|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Главные эукариотические ДНК-полимеразы
Более того, даже синтезированные при ее участии фрагменты Оказаки желательно удалить из отстающей нити. На N-конце ДНК-полимеразы a расположен домен (остатки 1-330), не существенный для полимеразной активности и сборки гетеротетрамерного комплекса. Этот домен может участвовать во взаимодействиях с другими белками и ассоциируется, например, с большим Т-антигеном вируса SV40. Взаимодействие Pola со связывающим онДНК белком RP-A (см. 2.2) стабилизирует связывание Pola с 3’-концом затравки РНК и повышает процессивность и точность синтеза ДНК. С-концевой домен (остатки 1300-1465) не нужен для каталитической активности, но участвует во взаимодействиях с праймазными субъединицами. В нем находится мотив цинковых пальцев, связывающий Zn2+. Вторая по величине субъединица В (р86 у дрожжей и р68 у млекопитающих) комплекса Pola-праймаза не обладает какой-либо ферментативной активностью, но играет важную роль формировании и поддержании структуры всего гетеротетрамерного комплекса. Ген POL12, кодирующий эту субъединицу у дрожжей, абсолютно необходим для жизнеспособности клеток. Более того, субъединица В требуется для каталитической активности Pola. Известно также, что субъединица В может стимулировать экспрессию субъединицы А. Кроме того, субъединица В фосфорилируется циклин-зависимыми протеинкиназами на стадии митоза во время клеточного цикла. Эта модификация может играть регуляторную роль, например, ингибировать активность Pola при инициации репликации. У млекопитающих субъединица р68 непосредственно контактирует с праймазным гетеродимером р55/p48, в котором субъединица р55 ассоциируется также с субъединицей р180. Праймазный субкомплекс р55/p48 может самостоятельно транслоцироваться в ядро, благодаря наличию сигнала ядерной локализации NLS у субъединицы р55. Субъединица А также имеет последовательность NLS (на N-конце у дрожжей и на С-конце млекопитающих). Тем не менее, при экспрессии порознь белки р180 и р68 остаются в цитоплазме. Для их ядерной транслокации требуется взаимодействие друг с другом. Вероятно, гетеродимер р180/р68 собирается в цитоплазме, транслоцируется в ядро и там соединяется с праймазным гетеродимером р55/p48 с образованием тетрамерного комплекса Pola-праймаза.
ДНК-полимераза b
ДНК-полимераза b (Polb) млекопитающих является самой маленькой из известных эукариотических ДНК-полимераз и относится к семейству Х, к которому принадлежит, например, и терминальная нуклеотидилтрансфераза. Polb имеет длину 335 остатков (мол. масса 39 кД) и состоит из двух доменов, соединенных чувствительным к протеазам линкером. Короткий N-концевой домен (8 кД) может связываться с онДНК и с 5’-концом нити ДНК в ОР или однонитевой бреши. Этот домен обладает 5’-дезоксирибозофосфатазной активностью, т.е. способен удалять с 5’-конца нити ДНК остатки 5’-дезоксирибозофосфата (без присоединенного к сахару основания) или 5’-дезоксирибонуклеотидфосфата. Эта реакция идет по механизму b-элиминации, а не гидролиза. На промежуточной стадии отщепляемый 5’-дезоксирибозофосфат ковалентно связывается с остатком лизина в домене 8 кД. С-концевой домен (31 кД) обладает полимеразной активностью, которая способна заполнять в днДНК короткие однонитевые пробелы по дистрибутивному механизму. ДНК-полимераза b обычно ресинтезирует в ДНК участки длиной 1-2 остатка, отрываясь от конца затравки после каждого акта включения нуклеотида. Подобно другим ДНК-полимеразам, 3-мерная структура Polb содержит домены ладони, большого пальца и пальцев, но они сильно редуцированы (рис. 1.12). В домене ладони находится триада остатков асп (положения 190, 192 и 256), участвующая в связывании двух каталитических катионов Mg2+. Однако по механизму связывания матрицы Polb отличается от других ДНК-полимераз. Это может обусловливать дистрибутивный характер ее действия.
Рис. 1.12. Модель 3-мерной структуры тройного комплекса ДНК-полимеразы b крысы с ДНК и ди-дНТФ. 1 – сайт связывания входящего нуклеотида, 2 – сайт связывания ДНК, 3 – матрица, 4 – затравка А – N-концевой домен, В – аналог домена большого пальца, С – домен ладони, D – аналог домена пальцев
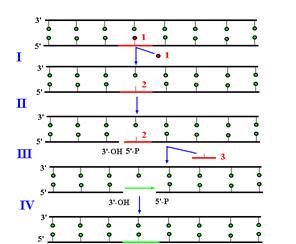
Рис. 1.13. Участие ДНК-полимеразы b в эксцизионной репарации оснований с короткими заплатками. I – удаление модифицированного основания ДНК-гликозилазой, II – образование ОР с 5’-стороны от АР-сайта АР-эндонуклеазой, III– удаление АР-сайта с освобождением 5’-дезоксирибозофосфата, IV – заполнение однонитевого пробела ДНК-полимеразой b и лигирование ДНК-лигазой. 1 – модифицированное основание, 2 – АР-сайт, 3 – 5’-дезоксирибозофосфат.
Уже давно было установлено, что ДНК-полимераза b участвует не в репликации, а в репарации ДНК. Две каталитические активности Polb делают ее идеально приспособленной к участию в эксцизионной репарации оснований (рис. 1.13). В клетках человека Polb отвечает за репарацию 75% повреждений ДНК, исправляемых по этому механизму. К числу таких повреждений относятся остатки урацила, ошибочно встроенные репликативными ДНК-полимеразами вместо тимина, а также некоторые типы модифицированных оснований, возникающие при действии на ДНК алкилирующих агентов, окислительных агентов и ионизирующей радиации. Первый этап этого пути (удаление модифицированного основания) катализируют ДНК-гликозилазы (например, урацил-ЛНК-гликозилаза), которые разрушают N-гликозидную связь между основанием и дезоксирибозой в остове ДНК. В результате их действия в ДНК образуется апуриновый/апиримидиновый АР-сайт. Этот сайт узнается АР-эндонуклеазами. Некоторые из них вызывают появление ОР с 3’-гидроксильным и 5’-фосфатным концами, расположенного с 5’-стороны от АР-сайта. Этот ОР служит местом посадки ДНК-полимеразы b, которая вначале за счет 5’-дезоксирибозофосфатазной активности удаляет из поврежденной нити 5’-дезоксирибозофосфат (т.е. убирает АР-сайт), а затем заполняет образовавшийся однонуклеотидный пробел полимеразной активностью. Завершает репарацию воссоединение ОР под действием ДНК-лигазы. Трансгенные мыши с гомозиготной делецией гена Polb нежизнеспособны: их эмбрионы выживают только в течение 10 дней после оплодотворения. Линии клеток млекопитающих, гомозиготные по делеции этого гена, сохраняют жизнеспособность, но проявляют дефект по эксцизионной репарации оснований и имеют повышенную чувствительность к алкилирующим агентам (но не к УФ-свету и ионизирующей радиации). У дрожжей S. cerevisiae имеется ген POL4, который кодирует белок длиной 582 остатка. С-концевая область этого белка гомологична ДНК-полимеразам b млекопитающих и содержит 5’-дезоксирибозофосфатазный и полимеразный домены. Функции N-концевого удлинения (~200 остатков) неизвестны. Нулевые мутанты дрожжей по гену POL4 не дефектны по эксцизионной репарации оснований и не проявляют повышенную чувствительность к алкилирующим агентам. Биологическая роль продукта гена POL4 пока окончательно не установлена. Дрожжевой белок Pol4 является ортологом ДНК-полимеразы l млекопитающих.
ДНК-полимераза g ДНК-полимераза g (Polg), кодируемая ядерными генами, является единственной эукариотической ДНК-полимеразой, участвующей в репликации митохондриальной ДНК (мтДНК), которая идет по непрерывному механизму (см. гл. 00). Большая субъединица Polg имеет мол. массу ~ 140 кД (р140) и высококонсервативна у всех эукариотов (степень идентичности между белками р140 дрожжей и человека составляет 42%). Очищенная большая субъединица Polg обладает не только ДНК-полимеразной, но и корректорской (3’®5’)-экзонуклеазной активностью. Подобно ДНК-полимеразе b, Polg имеет 5’-дезоксирибозофосфатазный домен и может удалять из ДНК 5’-дезоксирибозофосфат по каталитическому механизму b-элиминации. У многоклеточных эукариотов, но не у дрожжей, Polg является гетеродимером и, кроме субъединицы р140, содержит малую вспомогательную субъединицу с мол. массой 55 кД (р55). Субъединица р55, связываясь с р140, повышает скорость полимеризации ДНК в 5 раз и увеличивает процессивность Polg в 100 раз, т.е. играет роль фактора процессивности ДНК-полимеразы g. Это обусловлено повышением в присутствии р55 сродства субъединицы р155 к матричному концу ДНК в 100 раз. Сравнение аминокислотных последовательностей субъединиц р55 человека, мыши, крысы и дрозофилы показало, что у них наиболее консервативен С-концевой домен длиной ~ 120 остатков, по укладке похожий на аминоацил-тРНК-синтетазы класса IIa. Он состоит из 5-нитевого b-слоя, окруженного четырьмя a-спиралями, и необходим для взаимодействия р55 с субъединицей р140. Вспомогательная субъединица р55 по структуре похожа также на N-концевой домен субъединицы d’ в g-комплексе ДНК-полимеразы III E. coli. мтДНК постоянно находится в окислительном окружении внутри митохондрий и подвергается сильному окислительному повреждению. Поэтому скорость нуклеотидных замен в мтДНК в 10 раз выше, чем в ядерной ДНК. Поддержание целостности мтДНК зависит от эффективных систем репарации, обязательным участником которых является ДНК-полимераза g. В частности, Polg способна, подобно ДНК-полимеразе b, принимать участие в эксцизионной репарации оснований и удалять из ДНК АР-сайты после их инцизии АР-эндонуклеазами. ДНК-полимераза g необходима также для эффективной нуклеотидной эксцизионной репарации мтДНК и способна к ограниченному синтезу напротив повреждений в матричной нити ДНК. Так, Polg преимущественно включает остаток dA напротив АР-сайтов или остатков 8-оксо-dG (продукта окислительного повреждения ДНК).
ДНК-полимеразы d и e Гетеромультимерные ДНК-полимеразы g и e (Polg и Pole) участвуют не только в репликации ДНК, но и в нуклеотидной эксцизионной репарации, эксцизионной репарации оснований, коррекции ошибочно спаренных оснований, репарации двунитевых разрывов ДНК и рекомбинации и являются наиболее самыми важными из эукариотических ДНК-полимераз. Они относятся к полимеразному семейству В. Самая большая субъединица (А) Pold наиболее консервативна среди эукариотических ДНК-полимераз этого семейства: у человека и дрожжей она идентична на 49%, а у человека и мыши – на 98%. В то же время идентичность больших А-субъединиц Pole у человека и мыши составляет всего 39%.

Рис. 1.14. Схема доменной организации больших субъединиц эукариотических ДНК-полимераз d (А) и e (В). I – N-концевой домен, II - (3’®5’)-экзонуклеазный домен, III – полимеразный домен, IV – домен цинковых пальцев, V – уникальный С-концевой домен ДНК-полимераз e
Большая субъединица Pold, имеющая длину ~ 1100 остатков у дрожжей S. cerevisiae, cостоит из 4 доменов (рис. 1.14, А). N-концевой домен (остатки 1-200) наименее консервативен и содержит сигнал ядерной локализации NLS. Этот домен может участвовать во взаимодействиях с циклин-зависимыми протеинкиназами и ядерным антигеном пролиферирующих клеток PCNA. Более консервативен С-концевой домен (остатки 850-1110), содержащий три почти идентичных блока и домен цинкового пальца, на 98% совпадающий у Pold дрожжей и человека. Между этими доменами расположены основные каталитические области: (3’®5’)-экзонуклеазный домен (остатки 200-430) и ДНК-полимеразный домен (остатки 450-850) с такими же консервативными мотивами А и С активного центра, как у ДНК-полимеразы a. Большая субъединица ДНК-полимеразы e у S. cerevisiae имеет длину 2222 остатка, т.е. вдвое длиннее большой субъединицы Pold. В N-концевой половине, в которой расположены (3’®5’)-экзонуклеазный и полимеразный домены, эти различия не столь заметны. Правда, в полимеразном домене Pole последовательности консервативных мотивов А (ELDTDG) и С (DxxAMYPN) изменены по сравнению с ДНК-полимеразами a и g, но триада кислых остатков асп каталитического центра сохранилась. Главная особенность ДНК-полимераз e состоит в существовании огромного С-концевого домена длиной около 1000 остатков, имеющегося только у Pole. На С-конце большой субъединицы Pole расположены очень кислая область и консервативный домен цинкового пальца (остатки 2100-2200), состоящий из двух связывающих Zn2+ модулей типа С4 (ZF1 и ZF2), разделенных спейсером. C-концевой домен Pole используется для белок-белковых взаимодействий, существенных для физиологических функции ДНК-полимеразы e. ДНК-полимераза d считается главным ферментом, ответственным за элонгацию по время репликации эукариотической ДНК. Этот вывод основан на генетическом и биохимическом анализе частично дефектных по Pold мутантов почкующихся и делящихся дрожжей и особенно на реконструкции in vitro репликации минихромосом вируса SV40. В этой вирусной системе для репликации требуются две клеточных ДНК-полимеразы. ДНК-полимераза a и ассоциированная с ней праймаза синтезируют затравки РНК-ДНК для инициации синтеза ведущей нити и каждого из фрагментов Оказаки в отстающей нити. Последующую элонгацию ведущей нити и завершение фрагментов Оказаки в отстающей нити (см. гл. 4) катализирует Pold, которая не требует помощи Pole. Более того, в опытах in vivo установлено, что с реплицирующейся ДНК вируса SV40 сшиваются ДНК-полимеразы a и d, но не Pole. Таким образом, в частном случае репликации вирусной ДНК роль ДНК-полимеразы e не обнаруживается. Тем не менее, Pole явно имеет отношение к репликации хромосомной ДНК эукариотических клеток. Антитела к Pole человека ингибируют репликацию хромосомной ДНК в человеческих фибробластах, а в клетках почек обезьяны Pole сшивается с вновь синтезированной хромосомной ДНК. Нокаут гена POL2, кодирующего большую субъединицу Pol2 ДНК-полимеразы e у S. cerevisiae, летален и вызывает дефект по репликации ДНК. Однако комплементацию этого дефекта вызывает не полимеразный домен, а изолированный С-конце вой домен белка Pol2 с мол. массой 120 кД. Вместе с тем, даже точечные мутации или маленькие делеции, затрагивающие домены цинковых пальцев на самом С-конце этого белка, вызывают дефект по репликации хромосом и по контрольной точке S/M клеточного цикла, предотвращающей сегрегацию нереплицированных или поврежденных хромосом. Поэтому высказывается предположение, что незаменимой областью большой субъединицы Pole является не полимеразный, а уникальный и консервативный у всех эукариотов С-концевой домен, участвующий в регуляторных событиях клеточного цикла. Тем не менее, в отличие от полной делеции полимеразного домена Pole, точечные мутации в этом домене летальны для дрожжей. Эти данные позволяют предположить, что функцию Pole в синтезе ДНК могут заменить другие ДНК-полимеразы, например Pold, но они не заменяют регуляторную функцию уникальной С-концевой половины. Точечные мутации в полимеразном домене могут препятствовать такой замене синтетической функции Pole или же оттитровывают какие-то клеточные факторы, существенные для репликации. Истинная роль Pole в репликации пока остается невыясненной. Возможно, ДНК-полимераза e участвует в поздних стадиях синтеза отстающей нити или же реплицирует клеточные хромосомы только в самом конце фазы S клеточного цикла. ДНК-полимеразы d и e являются гетеромультимерными комплексами, в состав которых входят не только большие субъединицы А, но и несколько вспомогательных субъединиц меньшего размера. Их число равно 2 у S. cerevisiae, 3 у человека и 4 у делящихся дрожжей Schizosaccharomyces pombe в случае Pold и 3 в случае Pole у всех этих видов (табл. 1.3). Гомология малых субъединиц между разными видами гораздо меньше (20-25%), чем гомология больших субъединиц, а функции вспомогательных белков изучены еще недостаточно. Эти дополнительные субъединицы могут участвовать, например, в сборке и/или поддержании стабильности целых репликазных ансамблей. У ДНК-полимеразы d S. cerevisiae вспомогательные субъединицы р58 и р55, похожие на субъединицы р50 и р66 человека, кодируются соответственно существенным геном POL31 и несущественным геном POL32. Мутант с нокаутированным геном POL32 жизнеспособен, но холодочувствителен по репликации и про вляет повышенную чувствительность к агентам, повреждающим ДНК. Продукт этого гена связывает ядерный антиген пролиферирующих клеток PCNA. Белки р55 и р58, экспрессированные порознь, находятся в димерной форме, а при одновременной экспрессии образуют гетеротетрамер (р55-р58)2. При коэкспрессии р55 с большой субъединицей р125 образуется их гетеродимер. В клетках дрожжей дикого типа обнаружена наиболее высокомолекулярная форма ДНК-полимеразы d - (р125-р58-р55)2 с мол. массой ~500 кД, являющаяся димером гетеротримера всех 3 субъединиц. При реконструкции Pold человека из субъединиц р125, р50, р66 и р12, экспрессированных рекомбинантными бакуловирусами в клетках насекомых, обнаружены 3-субъединичный (р125-р66-р50) и 4-субъединичный (р125-р66-р50-р12) субкомплексы, причем ДНК-полимеразная активность у последнего в 15 раз выше, чем у первого. Это показало, что для оптимальной полимеразной активности Pold требуется даже самая маленькая субъединица р12, отсутствующая у почкующихся дрожжей. Вероятно, активной формой ДНК-полимеразы d человека является димер 4-субъединичного субкомплекса. ДНК-полимераза e дрожжей состоит из субъединиц р256, р80, р23 и р22. При коэкспрессии этих рекомбинантных субъединиц в различных сочетания обнаружены гетеродимерные субкомплексы р256-р80 и р23-р22, которые ассоциируются друг с другом с образованием гетеротетрамера. Субъединица р80 сама способна образовывать гомодимер, а гетеродимер р256-р80 димеризуется с образованием гетеротетрамера (р256-р80)2. За димеризацию гетеродимера отвечает субъединица р80, для взаимодействия с которой необходима и достаточна С-концевая половина р256, включая домен цинковых пальцев. У Pole человека две самые маленькие субъединицы (р17 и р12) также взаимодействуют с двумя самыми большими субъединицами (р261 и р59) и образуют гетеротетрамерный комплекс. По-видимому, общим свойством эукариотических ДНК-полимераз d и e является образование комплексов, в которые входят две молекулы самой большой субъединицы, ответственной за полимеразную активность, как и в случае бактериальной ДНК-полимеразы III. Продолжая эту аналогию с бактериальными репликазами, можно ввести понятие холоферментов Pold и Pole, в состав которых, помимо главной полимеразной субъединицы и вспомогательных белков, входят скользящий зажим (белок PCNA) и его погрузчик (пентамерный белок RF-C). В присутствии белка PCNA процессивность ДНК-полимеразы d увеличивается с 1200 до 3500, а при анализе стационарной кинетики синтеза ДНК – с 100 до нескольких тысяч. PCNA облегчает образование комплекса Pold-ДНК и уменьшает константу скорости диссоциации этого комплекса. ДНК-полимераза e проявляет достаточно высокую процессивность при низкой ионной силе и в отсутствие PCNA, но в физиологических условиях (в присутствии 0,15 М NaCl) становится непроцессивной, и тогда PCNA способствует восстановлению высокой процессивности. ДНК-полимеразы археев
По ультраструктуре клеток представители третьего домена живых организмов археи (Archaea) похожи на бактерии и относятся к прокариотам. Их метаболические процессы в целом также похожи на бактериальные. Однако весь аппарат обработки генетической информации (транскрипции, трансляции и репликации ДНК) у археев гораздо ближе к аппарату эукариотов. У археев как РНК-полимеразы, так и ДНК-полимеразы напоминают эукариотические ферменты. Домен археев подразделяется на два субдомена: кренархеи (Crenarchaeota) и эуриархеи (Euryarchaeota). К первому классу относятся такие археи, как Sulfolobus, а ко второму – такие, как Pyrococcus. Наборы ДНК-полимераз у кренархеев и эуриархеев не одинаковы. Оба субдомена археев имеют мономерные ДНК-полимеразы семейства В с мол. массой ~ 100 кД, похожие на эукариотические ДНК-полимеразы a, g и e.Они содержат в полимеразном активном центре типичные мотивы семейства В (YGDTDS и DxxSLIPS) и обладают (3’®5’)-экзонуклеазной активностью. У кренархеев имеются по меньшей мере две разные ДНК-полимеразы этого класса (PolBI и PolBII), а у эуриархеев – только одна ДНК-полимераза PolB, которая долгое время считалась их единственной ДНК-полимеразой. В дальнейшем оказалось, что наряду с PolB эуриархеи содержат вторую, гетеродимерную ДНК-полимеразу PolD, которая высокогомологична у различных эуриархеев, но не имеет гомологов у других организмов и выделена в новое семейство D. ДНК-полимераза PolD состоит из большой каталитической субъединицы DP2 с мол. массой ~ 130-140 кД, обладающей (3’®5’)-экзонуклеазной активностью, и вспомогательной малой субъединицы DP1 с мол. массой ~ 70 кД, которая обладает слабой, но достоверной гомологией с субъединицей р66 ДНК-полимеразы d. Малая субъединица DP1 имеет древние «пирофосфатазные» мотивы, как у эубактериальных ДНК-полимераз III, и содержит типичный мотив связывания эукариотических факторов процессивности. Все ДНК-полимеразы археев нуждаются для высокой процессивности в скользящем зажиме, который похож на эукариотический белок PCNA. Погрузку этого белка с мол. м. ~ 29 кД у археев вызывает комплекс RF-C, аналогичный эукариотическому, но состоящий не из пяти, а из двух разных субъединиц.
Поиск по сайту: |