|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Классификация ДНК-полимераз
*- выделены кислые аминокислотные остатки активного центра; h – гидрофобные аминокислотные остатки
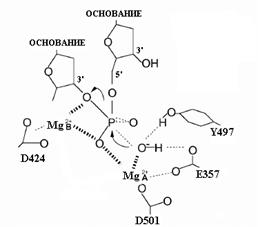
– только у эукариотов(табл. 1.1). Несмотря на низкую степень гомологии между ДНК-полимеразами из разных семейств, все они содержат во многих случаях одни и те же группы консервативных аминокислотных остатков (области А и С), в которые входят два или чаще три кислых остатка аспарагиновой и глутаминовой кислот, необходимые для связывания двух катионов 2-валентных металлов, которые металлов, которые участвуют в каталитическом механизме, представленном на рис. 1.1А. Сайт-направленный мутагенез подтвердил, что эти консервативные кислые остатки абсолютно необходимы для полимеразной активности. Такие же сочетания существенных кислых аминокислотных остатков содержатся и в активных центрах обратных транскриптаз и РНК-полимераз. Таким образом, механизм катализа с участием 2 катионов Mg2+, координируемых остатками асп и глу, является универсальным для ферментов биосинтеза полинуклеотидов ДНК и РНК. Кроме полимеразной активности, многие ДНК-полимеразы обладают экзонуклеазными активностями. Большинство ДНК-полимераз имеет (3’®5’)-экзонуклеазную активность, которая удаляет из вновь синтезированной нити последний включенный остаток на 3’-конце, укорачивая растущую цепь на один нуклеотид и освобождая 5’-дНМФ. Эта реакция очень специфична и требует присутствия 3’-ОН-группы в дезоксирибозе последнего нуклеотида цепи ДНК. Она идет наиболее эффективно, если последний включенный нуклеотид является «ошибочным» и не комплементарен соответствующему основанию матрицы. Такая реакция используется для исправления (коррекции) ошибок, допущенных ДНК-полимеразой в процессе синтеза ДНК (гл. 00). Механизм (3’®5’)-экзонуклеазной активности формально аналогичен механизму самой полимеразной реакции и состоит в нуклеофильной атаке гидроксильного иона ОН- на (3’,5’)-фосфодиэфирную связь при участии двух катионов 2-валентных металлов (Mg2+, Mn2+ или Zn2+). Эти катионы связываются с консервативными кислыми остатками асп (или глу) в экзонуклеазном активном центре (рис. 1.2). Молекула воды, координационно связанная с катионом металла А, образует атакующий анион ОН-, который занимает правильное положение относительно мишенной фосфодиэфирной связи в переходном комплексе. В этом комплексе атом Р расщепляемой связи находится в центре треугольной бипирамиды, апикальные положения которой занимают атакующий гидроксильный анион и 3’-ОН-группа предпоследнего нуклеотида растущей нити ДНК. Катион металла В стабилизирует уходящую 3’-OH-группу этого остатка и помогает установлению правильных углов связей О-Р-О в симметричном переходном комплексе.
Рис. 1.2. Переходное состояние в (3’®5’)-экзонуклеазной реакции, катализируемой ДНК-полимеразой I E. coli. Главными лигандами двух катионов Mg2+ являются остатки D424 и D501. Роль карбоксильной группы Е357 как лиганда катиона металла является менее существенной, но этот остаток необходим для экзонуклеазной активности. Расположенный рядом с активным центром остаток Y497 может участвовать в установлении правильного положения субстрата
Гораздо реже встречается (5’®3’)-экзонуклеазная активность, которая характерна, например, для бактериальных ДНК-полимераз I. Они обладают уникальной способностью начинать синтез ДНК in vitro на однонитевом разрыве (ОР, или «ник» на лабораторном жаргоне) в днДНК, имеющем смежные свободные 3’-гидроксильный и 5’-фосфатный концы, и используют 3’-ОН-конец в месте разрыва для удлинения нити ДНК. По мере синтеза нового сегмента ДНК он вытесняет гомологичный 5’-сегмент нити из дуплекса («синтез ДНК со смещением нити», displacement synthesis). Смещенный сегмент ДНК последовательно разрушается под действием (5’®3’)-экзонуклеазной активности полимеразы (рис. 1.4). В процессе деградации освобождаются преимущественно (в 80% случаев) 5’-мононуклеотиды – продукты гидролиза ближайшей к 5’-концу фосфодиэфирной связи. Однако могут освобождаться и олигонуклеотиды, т.к. фермент способен расщеплять фосфодиэфирные связи на расстоянии до 10 н. от 5’-фосфатного конца в области ОР. Строго говоря, (5’®3’)-экзонуклеазу ДНК-полимераз следует называть 5’-нуклеазой. Эта активность может гидролизовать не только нить ДНК, но и РНК, спаренную с комплементарной нитью ДНК, т.е. действовать как РНКаза Н. 5’-нуклеазная активность ДНК-полимераз используется в процессах репарации и для удаления праймеров РНК из отстающей нити (гл. 3). При согласованном синтезе-расщеплении ДНК-полимеразами I in vitro происходит простое перемещение ОР по нити ДНК в направлении 5’®3’ (рис. 1.3). Этот феномен называется «переносом ОР» (nick translation). Он часто используется для введения радиоактивной метки в днДНК in vitro. В бактериальных и фаговых 5’-экзонуклеазах обнаружены 9 консервативных кислых аминокислотных остатков асп или глу. Сайт-направленный мутагенез показал, что многие из них существенны для нуклеазной активности. Это позволило предположить, что 5’-нуклеазная реакция, подобно полимеразной и (3’®5’)-экзонуклеазной реакциям, катализируется двумя катионами 2-валентных металлов, координационно связанными с карбоксильными группами остатков асп и глу. Однако рентгеноструктуктурный анализ нескольких родственных 5’-нуклеаз не позволил однозначно установить положения связанных с активным центром катионов металлов и геометрию их лигандов.
Рис. 1.3. Схема процесса переноса ОР, катализируемого ДНК-полимеразой I. I – полимеразный домен ДНК-полимеразы, II – 5’-нуклеазный домен
Процессы синтеза ДНК, катализируемые ДНК-полимеразами, разделяются на репаративные и репликативные. Репаративный синтез ДНК используется для заполнения однонитевых брешей в днДНК, образующихся во время эксцизионной репарации, коррекции ошибочно спаренных оснований или рекомбинационной репарации. Рассмотрим этот процесс на примере нуклеотидной эксцизионной репарации (рис. 1.3). Репаративные эндонуклеазы (эксцинуклеазы) узнают поврежениеповреждение (например, циклобутановый пиримидиновый димер) в нити ДНК и разрезают ее на определенных расстояниях с 3’- и 5’-стороны от повреждения с образованием ОР. Фрагмент ДНК, расположенный между этими ОР и содержащий повреждение, должен быть освобожден из дуплекса, чтобы создать однонитевую матрицу ДНК для репаративного синтеза. Для этого используется расплетание нитей днДНК, катализируемое специализированными ферментами – ДНК-геликазами (см. гл. 2), например, ДНК-геликазой UvrD E. coli. В ДНК возникает однонитевая брешь длиной 13 н. в случае бактерий и 29 н. в случае эукариотов. Она служит посадочной площадкой для связывания с онДНК ДНК-полимераз, включая те, которые не могут инициировать синтез ДНК на ОР. ДНК-полимеразы используют 3’-ОН-конец нити ДНК в бреши в качестве сайта инициации (затравки) для репаративного ресинтеза и удлиняют этот конец, последовательно копируя матрицу неповрежденной нити и заполняя пробел. Синтез часто останавливается перед противоположным 5’-концом ДНК в бреши, и в ДНК остается ОР со смежными 3’-гидроксильным и 5’-фосфатным концами. Воссоединение этих концов ДНК-лигазами (гл. 2) восстанавливает целостность репарируемой нити. Рис. 1.4. Репаративный синтез ДНК в процессе нуклеотидной эксцизионной репарации. 1 – инцизия поврежденного участка нити ДНК эксцизионными эндонуклеазами, 2 – расплетание сегмента нити ДНК между ОР ДНК-геликазой и освобождение этого сегмента из дуплекса, 3 – репаративный ресинтез однонитевой бреши ДНК. I – эксцизионная эндонуклеаза, II – ДНК-геликаза, III – ДНК-полимераза
Репликация ДНК состоит, как правило, в образовании двух дочерних копий днДНК всех компонентов генома (хромосом и эписом или плазмид). При репликации синтезируются две новые нити, комплементарные нитям родительского дуплекса ДНК. В результате каждый родительский дуплекс замещается двумя дочерними, состоящими из одной родительской и одной вновь синтезированной нитей. Репликация является полуконсервативной, т.к. консервативными единицами являются одиночные нити родительской днДНК. Главные ДНК-полимеразы, на долю которых приходится большая часть репликативного синтеза ДНК, иногда называют ДНК-репликазами. Остальные ДНК-полимеразы играют вспомогательную роль в репликации ДНК и/или участвуют в репаративном синтезе. Их иногда называют репаративными ДНК-полимеразами, но этот термин не является строгим. Процесс репликации состоит из трех последовательных стадий: инициации (начала синтеза ДНК) , элонгации (ростьа цепи ДНК) и терминации (окочанияокончания синтеза). Репликация обычно начинается в одном или многих специфических сайтах генома, которые называются областями начала репликации (ОНР, или ori от origin). Область, в которой репликация ДНК останавливается, называется область окочанияокончания репликации (terminus). Эти контрольные элементы определяют единицу репликации ДНК, называемую репликоном. Первой существенной стадией в инициации репликации является локальное раскрывание (расплетание) двойной спирали ДНК, дающее ДНК-полимеразам доступ к одиночным матричным нитям ДНК. Сами ДНК-полимеразы неспособны вызывать раскрывание дуплекса во внутренних участках, хотя при репаративном синтезе со смещением нити могут проявлять ограниченную способность расплетать расположенную перед ними днДНК на ОР или однонитевых брешах. Существование специализированных ОНР повышает эффективность репликации ДНК, создавая места для сборки состоящих из многих белков комплексов репликативного синтеза ДНК, или реплисом. В сборке этих комплексов важную роль играют специфические ДНК-белковые и белок-белковые взаимодействия. Первичное открывание дуплекса ДНК обычно вызывается специфическим белком-инициатором, обладающим способностью узнавать нуклеотидную последовательность ОНР. Оно облегчается особенностями структуры ДНК ОНР (например, негативной суперспирализацией ДНК или присутствием в ОНР «легкоплавких» участков ДНК) и некоторыми вспомогательными белками (например, связывающими онДНК белками типа SSB). Первичное раскрывание дуплекса создает предпосылки для образования репликативной вилки (точки ДНК, в которой комплементарные нити расходятся и дают ДНК-полимеразам возможность синтезировать ДНК). В установлении репликативной вилки важную роль играет погрузка на разошедшиеся нити ДНК-геликаз – ферментов, использующих энергию гидролиза НТФ для однонаправленной транслокации по нити ДНК и плавления дуплекса. На некоторых ОНР погрузка ДНК-геликазы осуществляется на обе разошедшиеся нити. Это приводит к образованию двух репликативных вилок, перемещающихся по дуплексу ДНК в разных направлениях, так что репликация ДНК является двунаправленной. На других ОНР устанавливается только одна репликативная вилка, и начинается однонаправленная репликация. В отличие от РНК-полимераз, ДНК-полимеразы и обратные транскриптазы не могут инициировать синтез ДНК de novo, т.е. синтезировать первый динуклеотид из двух дНТФ. Они нуждаются для инициации в затравке, или” праймере” (primer). Во время репаративного синтеза ДНК-полимеразы элонгируют уже установившуюся нить ДНК, свободный 3’-OH-конец которой и служит затравкой. Роль праймера в репликации ДНК обычно играют короткие цепи РНК. Лишь некоторые фаговые и вирусные ДНК-полимеразы (например, у фага f29 Bacillus subtilis или аденовирусов) могут использовать для инициации репликации белковые праймеры, в которых боковые гидроксильные группы остатков тирозина, серина или треонина играют такую же роль акцептора дНТФ, как 3’-OH-группа на конце полинуклеотидной цепи. Ретровирусы могут использовать в качестве затравки для инициации обратной транскрипции готовые природные тРНК клеток хозяина. В остальных случаях затравки РНК необходимо синтезировать de novo. Наиболее часто синтез праймеров катализируется специальным классом ДНК-зависимых РНК-полимераз, так называемыми праймазами. Однако у бактерий иногда (например, при инициации репликации некоторых плазмид) затравка РНК может синтезироваться обычной РНК-полимеразой. У эукариотов в синтезе митохондриальной ДНК также участвует не стандартная праймаза, а митохондриальная РНК-полимераза. Праймазы вовлекаются в инициацию новых цепей ДНК геликазами, расположенными в репликативных вилок. Образовавшийся комплекс, содержащий геликазу и праймазу, называется праймосомой. В зависимости от частоты и распределения событий синтеза праймеров процессы репликации ДНК разделяются на непрерывные и полунепрерывные. При непрерывной репликации комплементарные нити дочерней ДНК синтезируются по-очереди (рис. 1.5, А). Вначале образуется праймер для копирования нижней нити родительского дуплекса. ДНК-полимераза элонгирует этот праймер, ведя синтез со смещением верхней родительской нити до конца матрицы нижней нити. Затем происходит независимая репликация смещенной матрицы верхней нити, инициированная второй затравкой. Так реплицируются по механизму вращающегося кольца ДНК некоторых фагов и бактериальных плазмид и эукариотическая митохондриальная ДНК, а также молекулы линейной ДНК аденовирусов.
Рис. 1.4. Репаративный синтез ДНК в процессе нуклеотидной эксцизионной репарации. 1 – инцизия поврежденного участка нити ДНК эксцизионными эндонуклеазами, 2 – расплетание сегмента нити ДНК между ОР ДНК-лигазой и освобождение этого сегмента из дуплекса, 3 – репаративный ресинтез однонитевой бреши ДНК. I – эксцизионная эндонуклеаза, II – ДНК-геликаза, III – ДНК-полимераза
Рис. 1.5. Непрерывная (А) и полунепрерывная (В) репликация ДНК. Родительские нити ДНК изображены сплошными черными линиями, вновь синтезированные нити – прерывистыми красными линиями, а праймеры РНК – зелеными кружками. Тонкие красные стрелки указывают направление роста вновь синтезируемых нитей ДНК, а толстая красная стрелка – направление движения репликативной вилки. На рис. В красными цифрами обозначены ведущая нить (1) и отстающая нить (2)
При полунепрерывной репликации одна из дочерних нитей элонгируется непрерывно из одного праймера, использованного при инициации (рис. 1.6, В). Эта нить ДНК называется ведущей. Полимеризация непрерывной нити идет в том же направлении, в котором перемещается по дуплексу родительской ДНК репликативная вилка. Нить дочерней ДНК, комплементарная ведущей, называется отстающей. Синтез отстающей нити происходит одновременно с синтезом ведущей нити, но в направлении, противоположном движению репликативной нити. Такой синтез не может быть непрерывным, т.к. ДНК-полимеразы перемещаются по матричной нити ДНК только в одном направлении 3’®5’. Отстающая нить создается из дискретных коротких цепей ДНК, синтезируемых на матрице для этой нити в результате перемещения ДНК-полимеразы в стандартном направлении. Эти короткие цепи называются фрагментами Оказаки. Каждый из таких фрагментов должен инициироваться заново из праймеров РНК, синтезируемых праймазой. При полунепрерывной репликации для завершения синтеза отстающей нити требуется участие «репаративной» системы, которая удаляет праймеры РНК, заполняет образующиеся бреши и соединяет друг с другом короткие отрезки вновь синтезированной ДНК. В процессе полунепрерыной репликации участвуют сложные многокомпонентные машины репликации, называемые реплисомами. Сборку и работу этих машин у прокариотов и эукаритов мы рассмотрим с гл. 2-3. Однако вначале необходимо остановиться на свойствах основных типов ДНК, полимераз, участвующих в репликации и репарации.
Поиск по сайту: |