|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Домены DВР-А - DВР-D белка RPA изображены в виде ладоней, а онДНК – в виде стрелки
Праймазы
Синтез затравок РНК в процессе образования фрагментов Оказаки при репликации ДНК (преимущественно в отстающей нити) катализируется праймазами – особой разновидностью ДНК-зависимых РНК-полимераз, отличающейся от РНК-полимераз, которые участвуют в транскрипции. Рассмотрим их структурные особенности по сравнению с транскрипционными РНК-полимеразами на примере наиболее хорошо изученных ферментов – белка DnaG E. coli и эукариотической праймазы, всегда работающей в комплексе с ДНК-полимеразой a. Праймаза DnaG E. coli кодируется существенным геном dnaG (67-ая мин генетической карты) и имеет длину 582 остатка. Она почти не гомологична известным РНК-полимеразам (единственный участок гомологии RNAP имеет длину всего 15 остатков), но содержит 6 участков гомологии (1-6) с праймазами других бактерий и некоторых фагов. Эти участки гомологии сосредоточены в N-концевых 2/3 молекулы DnaG. За положением 400 гомология бактериальных и фаговыйх праймаз исчезает: эта С-концевая область у фаговых праймаз либо отсутствует, либо заменена на геликазный домен у праймаз-геликаз фагов Т7 и Р1. В первичной последовательности белка DnaG можно выделить 4 важные области (I-IV, рис 2.18). N-концевая область I c консервативным мотивом 1 содержит мотив цинкового пальца или ленты (положения 40-65) типа СХ2НХ17СХ2С с длинной центральной петлей и координационно связывает катион Zn2+. Эта область участвует в узнавании онДНК и связывании с нею и может частично определять положение стартовой точки синтеза РНК. Главным является центральный домен II (остатки 200-350), содержащий 4 из 6 консервативных праймазных мотивов и участок гомологии с РНК-полимеразами. В этой области сосредоточены 3 необходимых для катализа кислых остатка (асп269 в мотиве 4 и диада DXD в положениях 345-347 мотива 6), связывающие ионы Mg2+, и входящий в активный центр остаток лиз241, замена которого не мешает инициации затравок РНК, но препятствует их элонгации.
N I II III IV C 1 2 3 4 5 6
RNAP Toprim Рис. 2.18. Доменная организация праймазы DnaG E. coli. I – домен связывания с ДНК, II – центральный каталитический домен, III - линкерный домен, IV – домен взаимодействия с другими белками. 1-6 – консервативные участки бактериальных и фаговых праймаз, RNAP – участок гомологии с РНК-полимеразами, Toprim - область гомологии с ДНК-топоизомеразами
Рентеноструктурный анализ белка DnaG не обнаружил структурного сходства с известными РНК-полимеразами, но подтвердил основанную на первичной последовательности гомологию праймазы с ДНК-топоизомеразами. Центральная часть каталитического домена DnaG имеет укладку типа Toprim, характерную для топоизомераз классов 1 и 2 (см. 2.5). Этот домен имеет форму гребня и содержит центральную b-слой, окруженную несколькими a-спиралями (рис. 2.19). На вершине этой структуры находятся остатки асп, связывающие Mg2+ и необходимые для катализа. Впадина домена Toprim может слабо связывать дуплекс ДНК-РНК длиной 10 п.н. В этом канале расположен и остаток лиз241 из сегмента RNAP гомологии с РНК-полимеразами. Домен II через гибкий линкерный домен III в области остатка 400 соединен с уникальным для бактериальных праймаз С-концевым доменом IV. Последний участвует во взаимодействиях белка DnaG с другими компонентами аппарата репликации. В частности, последние 16 С-концевых остатков DnaG необходимы для взаимодействия с N-концевым доменом ДНК-геликазы DnaВ и участвуют в вербовке DnaG в репликативную вилку. Прямой физический контакт с DnaВ обеспечивает попадание расплетенной геликазой нити ДНК сразу к активному центру DnaG и стимулирует праймазную активность.
Рис. 2.19. Трехмерная структура активного фрагмента праймазы DnaG E. coli с разрешением 2,9 Å. Отмечены положения домена Toprim гомологии с топоизомеразами и остатков активного центра праймазы.
Эукариотические праймазы являются интегральными компонентами бифункционального фермента ДНК-полимераза a -праймаза (см. 1.00) и состоят из 2 субъединиц р55 и р48 с мол. м. 55 и 48 кД (у человека). Белки р55 и р48 образуют прочно ассоциированный комплекс, в формировании которого участвуют N- и C-концевые домены р55. Субъединица р55 имеет сигнал ядерной локализации и способна направлять субкомплекс р55-р48 в ядро независимо от полимеразного субкомплекса. Субъединица р55 участвует в ассоциации праймазного субкомплекса с главной субъединицей р180 ДНК-полимеразы a. Кроме того, белок р55 может связываться с онДНК и с дуплексом ДНК-РНК, образовавшися после синтеза праймерной РНК. Каталитической субъединицей праймазы является белок р48, который связывается с онДНК и катализирует образование фосфодиэфирных связей в РНК. Кристаллическая структура этой субъединицы пока не установлена.Однако есть основания полагать, что белок р48 относится к тому же семейству Х нуклеотидилтрансфераз, что и ДНК-полимераза b. Гомология последовательностей праймазы р48 и ДНК-полимеразы b позволяет предположить, что праймаза имеет конформацию кисти руки и содержит в субдомене ладони каталитическую триаду остатков асп109, асп111 и асп306, связывающих Mg2+. Таким образом бактериальные и эукариотические праймазы не похожи друг на друга ни по первичной, ни по третичной структуре. Тем не менее, сохранение триад кислых остатков показывает, что молекулярный механизм каталитической стадии у этих двух типов геликаз одинаков и состоит в опосредованной 2 катионами Mg2+ нуклеофильной атаке 3’-гидроксила растущего конца РНК на фосфодиэфирную связь в рНТФ, как и в случае ДНК-полимераз и типичных РНК-полимераз. Праймаза DnaG инициирует синтез затравок РНК преимущественно (в 60% случаев) на тринуклеотидном сайте 3’-GTC в матричной нити ДНК. В геноме E. coli имеются 205 тысяч таких сайтов на среднем расстоянии »23 н. друг от друга, чего достаточно для быстрой инициации синтеза РНК всех фрагментов Оказаки. Праймазы фагов Т7 и Т4 инициируют синтез праймерных РНК на других триплетах: 3’-T(C/T)G 3’-GTC соответственно. Различная специфичность этих праймаз частично объясняется разной структурой петли длиной 17 н. в мотиве цинкового пальца. Первый остаток G в сайте инициации существенен только для узнавания стартового сайта белком DnaG и не используется для включения нуклеотида в РНК. Синтез праймерной РНК de novo начинается на напротив второго остатка Т. На растущем 3’-конце РНК вначале образуется динуклеотид AG. Эта стадия, как и при инициации транскрипции РНК-полимеразами, является лимитирующей скорость синтеза праймера. Последующие 10 фосфодиэфирных связей образуются гораздо быстрее, и праймаза DnaG синтезирует затравку РНК длиной 11±1 н. Этот размер примерно соответствует длине гибрида ДНК-РНК, помещающегося в полости молекулы DnaG. Затем праймаза переходит в дистрибутивную моду и синтез РНК замедляется или прекращается. Обычно это сопровождается вытеснением праймазы с матрицы ДНК, механизм которого мы рассмотрим в главе 4. Короткая затравка РНК предается к ДНК-полимеразе III, которая синтезирует ДНК фрагмента Оказаки. Для эффективного синтеза РНК праймаза DnaG нуждается в физическом контакте с ДНК-геликазой DnaВ. Аналогично идет синтез праймерной РНК эукариотической праймазой. Однако она не требует для инициации специфических последовательностей в матрице ДНК и обычно начинает синтез напротив пиримидинов, так что на 5’-конце РНК-затравки всегда присутствует пурин. Эукариотическая праймаза в присутствии ДНК-полимеразы a также синтезирует короткие праймерные РНК с «единичной длиной», равной 7-10 н. Вместе с тем, в отсутствие ДНК-полимеразной активности эта праймаза способна элонгировать «единичные» праймеры РНК. Отметим, что бактериальные и эукариотические праймазы являются неточными полимеразами и в среднем включают один ошибочный нуклеотид на 30 н. вновь синтезированной РНК.
ДНК-лигазы
ДНК-лигазы катализируют образование фосфодиэфирной связи в однонитевом разрыве (ОР) днДНК между смежными 3’-гидроксильным и 5’-фосфатным концами разорванной нити. Для связывания ДНК-лигаз с ОР в днДНК абсолютно необходима 5’-фосфатная группа, а 3’-ОН-группа не обязательна. Однако обе группы требуются для реакции лигирования. ДНК-лигазы воссоединяют в ДНК только ОР, но не бреши, и пробел длиной даже в 1 н. полностью устраняет связывание фермента с ДНК. ДНК-лигазы участвуют в воссоединении фрагментов Оказаки, образующихся во время синтеза отстающей нити в процессе репликации. Кроме того, ДНК-лигазы устраняют ОР ДНК в процессах репарации и рекомбинации. Прототипом бактериальных ДНК-лигаз является продукт гена ligA (ранее lig), расположенного на 51-ой мин генетической карты E. coli. Эта ДНК-лигаза имеет длину 671 остаток (мол. м. 73,7 кД), вызывает воссоединение ОР во всех процессах метаболизма ДНК (репликации, репарации и рекомбинации) и является абсолютно необходимой для роста клеток. В последнее время в полностью секвенированном геноме E. coli была обнаружена открытая рамка считывания, названная ligB и кодирующая вторую, более короткую ДНК-лигазу длиной 562 аминокислотных остатка, гомологичную LigA. Лигаза LigB также катализирует воссоединение ОР в ДНК in vitro, но её физиологическая роль пока не установлена. У млекопитающих идентифицированы 4 разных типа ДНК-лигаз, содержащихся в ядерных экстрактах клеток. Главной функцией ДНК-лигазы I явлется воссоединение фрагментов Оказаки, хотя она участвует и в репарации ДНК. ДНК-лигаза I человека имеет длину 919 остатков (мол. м. 102 кД) и кодируется геном LIG1, расположенным в хромосоме 19 и содержащим 27 интронов. ДНК-лигазы IIIa, участвующая в эксцизионной репарации ДНК, и IIIb, (известная также как ДНК-лигаза II) кодируются альтернативно сплайсированными мРНК одного и того же гена, и их аминокислотные последовательности различаются только на С-конце. ДНК-лигаза IV по субстратной специфичности отличается от ДНК-лигаз I и III и у мышей является существенным белком. Она участвует в негомоогическом соединении концов ДНК во время репарации двунитевых разрывов ДНК. У дрожжей S. cerevisiae отсутствуют гомологи ДНК-лизаз III млекопитающих, а гомолог ДНК-лигазы IV кодируется геном DNL4/LIG4 и также участвует в негомологическом соединении концов ДНК. Главная ДНК-лигаза I у дрожжей кодируется ядерным геном CDC9. Продуктами этого гена являются два белка, которые транслируются в одной рамке считвания, но с использованием разных инициирующих кодонов. При инициации трансляции на первом кодоне АУГ образуется белок длиной 755 остатков, имеющий на N-конце функциональную предпоследовательность, которая нацеливает белок на экспорт в митохондрии. При инициации трансляции на втором кодоне АУГ образуется белок длиной 732 остатка, локализующийся в ядре. После отщепления пропоследовательности в митохондриях первая форма ДНК-лигазы I становится тождественной главной ядерной форме. Для активности ДНК-лигаз необходимы нуклеотидные кофакторы, в зависимости от природы которых лигазы можно разбить на два класса. ДНК-лигазы эукариотов, археев, бактериофагов, эукариотических вирусов и некоторых эубактерий используют в качестве кофакторов АТФ и относятся к классу I. ДНК-лигазы класса II, кофактором которых служит НАД+, имеются исключительно у эубактерий. ДНК-лигазы LigA и LigB у E.coli принадлежат к этому классу. АТФ-зависимые ДНК-лигазы гетерогенны по размеру (от 30 до >100 кД), а НАД-зависимые ДНК-лигазы являются высокогомологичными мономерными ферментами с мол. массами 70-80 кД. ДНК-лигазы двух разных классов почти не гомологичны друг другу, за исключением 5 из 6 мотивов последовательности, образующих активный центр суперсемейства нуклеотидилтрансфераз (см. рис. 2.00). Эти мотивы сохраняются и у кэпирующих ферментов эукариотических мРНК, к-рые близки к ДНК-лигазам по механизму действия, но используют в качестве субстрата ГТФ. Механизм реакции, катализируемой ДНК-лигазами разных классов, состоит из 3 последовательных стадий (рис. 2.20). Первая стадия заключается в активации лигазы – аденилировании с образованием ковалентного интермедиата фермент – АМФ (Е-АМФ), в котором остаток АМФ связан фосфоамидной связью с e-аминогруппой консервативного остатка лизина в консервативном мотиве I активного центра. АТФ-зависимые эукариотические и архейные лигазы используют АТФ при образовании комплекса Е-АМФ и освобождают на первой стадии пирофосфат. Для бактериальных ДНК-лигаз донором АМФ в реакции аденилирования служит НАД+, при расщеплении которого освобождается НМН+. Последующие две стадии одинаковы для лигаз обоих классов. Во время второй стадии АМФ переносится из комплекса Е-АМФ на 5’-концевую фосфатную группу ОР ДНК с образованием ковалентного интермедиата ДНК-АМФ с (5’®5’)-фосфоангидридной связью. Этот интермедиат является гораздо более короткоживущим, чем комплекс Е-АМФ. На заключительной стадии свободная 3’-гидроксильная группа ОР атакует (5'®5’)-связь в активированном комплексе ДНК-АМФ. Это сопровождается образованием фосфодиэфирной связи, устраняющей ОР в ДНК, и освобождением АМФ.
АТФ-зависимые ДНК лигазы НАД+-зависимые ДНК-лигазы
ЕрА (+ 5’-р-ДНК на 5’-конце ОР)
(+ ДНК-3’-OH на 3’-конце ОР) ДНК-р-ДНК + рА лигированная ДНК O t
ОН OH Рис. 2.20. Механизм лигирования ОР ДНК ДНК-лигазами двух классов. Представлена структура общего ковалентного интермедиата ЕрА
Несмотря на различия ДНК-лигаз двух разных классов, они выполняют близкие функции и могут замещать друг друга. Так, условно-летальный мутант E. coli, дефектный по НАД-зависимой лигазе LigA, полностью комплементируется активным фрагментом ДНК-лигазы I человека, а ДНК-лигаза LigA E. coli в свою очередь поддерживает митотический рост мутантов дрожжей с делециями генов CDC9 и LIG4, дефектных по АТФ-зависимым ДНК-лигазам I и/или IV. Однако бактериальная лигаза не исправляет дефект этих мутантов по экспцизионной репарации. Вероятно, для комплементации репаративного дефекта необходимы специфические взаимодействия ДНК-лигазы с родственными репаративными ферментами. Рассмотрим более детально строение ДНК-лигаз и механизм последней стадии катализируемых ими реакций на примере НАД-зависимой ДНК-лигазы Tfi из термофильной бактерии Thermus filiformis – первой ДНК-лигазы, для которой методом рентгеноструктурного анализа установлена 3-мерная структура. Этот фермент, как и все ДНК-лигазы, имеет модульную организацию и состоит из 4 основных доменов (рис. 2.21). Он имеет длину 667 аминокислотных остатков (мол. м. 75,9 кД).
Рис. 2.21. Структура ДНК-лигазы Tfi из T. filiformis. А. Домены и консервативные мотивы ДНК-лигазы Tfi. 1а – субдомен связывания НАД+, 1b – субдомен аденилирования, 2 – домен связывания олигонуклеотидов с укладкой ОВ, 3 – домен с цинковым пальцем и мотивом HhH спираль-шпилька-спираль, 4 – домен гомологии с белком BRCT; I, III, IV, V и VI – консервативные мотивы суперсемейства нуклеотидилтрансфераз. B. Трехмерная структура ДНК-лигазы Tfi. Указано положение отдельных доменов
Самым большим является N-концевой домен 1, состоящий из двух субдоменов. На самом конце находится субдомен 1а длиной 73 остатка, являющийся сайтом связывания кофактора НАД+. Субдомен 1b (остатки 73-317) образован 3 антипараллельными b-слоями и несколькими фланговыми a-спиралями и является доменом аденилирования. Субдомен 1b содержит остаток лиз116 активного центра, подвергающийся аденилированию. Следующий домен 2 является доменом связывания олигонуклеотидов, т.к. он имеет укладку связывания олигомеров ОВ, похожую на укладку взаимодействия с онДНК у связывающих он ДНК белков. Домены 1 и 2 содержат все 5 консервативных мотивов нуклеотидилтрансфераз и вместе образуют минимальный домен ДНК-лигазы, достаточный для каталитической активности, т.к. в их пределах расположены все каталитически существенные аминокислотные остатки и остатки, необходимые для специфического связывания ДНК-лигазы с ОР ДНК. Домены 1 и 2 физически взаимодействуют друг с другом, что вызывает значительное повышение аденилирующей активности домена 1. Для такого взаимодействия необходимо сильное изменение конформации белка со смещением С-концевой части домена 2 в сторону домена 1. Домен 3 (остатки 403-581) является вторым «некаталитическим» контактным участком, обеспечивающим связывание ДНК-лигазы с ДНК. Он образован 2 сегментами белка. Область остатков 403-429 содежит 4 консервативных остатка цистеина, образующих цинковый палец типа Сys4, а смежная область остатков 429-581 включает 4 копии мотива спираль-шпилька-спираль. Обе структуры часто используются белками для взаимодействия с ДНК. На самом С-конце ДНК-лигазы Tfi расположен необычный домен 4, или BRCT, гомологичный C-концевому домену эукариотического белка BRCA1, ассоциированного с раком молочной железы. Он состоит из 4-нитевого параллельного b-слоя и трех a-спиралей и имеется у очень многих лигаз. Домен 4 очень подвижен в так называемой «открытой» конформации ДНК-лигазы и сближен с N-концевым доменом 1а в «закрытой» конформации, в которой лигаза принимает тороидальную форму. Предполагается, что домен 4 играет в лигазе роль ворот, регулирующих связывание и освобождение днДНК. Подобно белку PCNA, в закрытой конформации ДНК-лигаза может образовывать скользящий зажим на ДНК и двигаться по ДНК до тех пор, пока она не встретит ОР. Аналогичную доменную структуру имеет ДНК-лигаза LigA E. coli, а в лигазе LigB отсутствуют два остатка цистеина цинкового пальца и весь С-концевой домен BRCT. Известная 3-мерная структура ДНК-лигазы Tfi позволила предложить следующую гипотетическую схему (рис. 2.22), которая, вероятно, является общей для многих типов ДНК-лигаз. В исходном состоянии (А) лигаза находится в закрытом неактивном состоянии и неспособна связываться с ДНК. Аденилирование под действием НАД+ или АМФ (стадия I) переводит лигазу в открытое активированное состояние (В), в котором она неспецифически связывается с днДНК, вновь переходит в закрытое состояние С (стадия II) и транслоцируется по днДНК до тех пор, пока не встретит ОР в одной из нитей. Узнавание ОР в ДНК (стадия III) сопровождается изгибанием ДНК и изменением конформации белка на контактной поверхности между доменами 1 и 2. В результате 5’- и 3’-концы ОР оказываются в щели между этими доменами и сближаются с аденилированным остатком лиз116. Это обеспечивает деаденилирование белка и перенос АМФ на 5’-конец разорванной нити (стадия IV). В этом состоянии лигаза связывает катионы Mg2+, необходимые для атаки 3’-гидроксильной группы нити ДНК на активированный АМФ 5’-конец онДНК (стадия V). В результате происходит воссоединение ОР, освобождение неорганического фосфата pi и изменение конформации лигазы с переходом в открытую форму (F). Лигированная ДНК освобождается от ДНК-лигазы, которая возвращается в исходное неактивное закрытое состояние А (стадия VI).
Рис. 2.22. Модель каталитического цикла ДНК-лигазы Tfi. I – аденилирование, II –связывание с ДНК, III – узнавание ОР и изгибание ДНК, IV – изменение конформации и деаденилирование фермента, V – воссоединение ОР и переход в открытую форму, V – освобождение ДНК. 1-4- домены ДНК-лигазы (см. рис. 2.21), 5 – ДНК с ОР; рi – неорганический фосфат. Стрелками указано положение связанной ДНК и АМФ в аденилированном ферменте
Рассмотрим более детально молекулярный механизм последней стадии лигирования – деаденилирования интермедиата ДНК-АМФ и образования фосфодиэфирной связи между концами ОР (рис. 2.23). В общих чертах, эта реакция протекает с участием 2-валентных катионов металлов так же, как и стадия полимеризации, катализируемой ДНК-полимеразами (см. 1.00). В механизме участвуют два катиона Mg2+, координационно связанные с карбоксильными группами остатков глу281, асп283 и асп118 в домене 1 ДНК-лигазы Tfi. Эти три остатка образуют отрицательно заряженный карман, расположенный рядом с аденилируемым остатком лиз116. Аденилированный интермедиат ДНК-АМФ в лигировании соответствует включаемому в ДНК 5’-дНТФ в реакции синтеза ДНК. В активный центр ДНК-лизазы Tfi входит также положительно заряженный остаток арг196, которые на предыдущей стадии узнавания ОР в ДНК мог электростатически взаимодействовать с отрицательно заряженным 5’-фосфатным концом ДНК. Аналогичную архитектуру активного центра, вероятно, имеют все ДНК-лигазы.
Рис. 2.23. Модель активного центра ДНК-лигазы Tfi на заключительной стадии IV (рис. 2.21) воссоединения ОР.
ДНК-топоизомеразы
Рис. 2.24. Образование (+)-супервитков перед рекликативной вилкой и прекатенанов позади неё в процессе репликации и появление структуры «куриной лапы» после остановки репликативной вилки и разборки реплисомы Таблица 2.2
Поиск по сайту: |




 1 100 200 300 400 500 582
1 100 200 300 400 500 582









 Е + рррА Е + НАД+
Е + рррА Е + НАД+ (-PPi) (-НМН+)
(-PPi) (-НМН+) Арр-ДНК (+ Е)
Арр-ДНК (+ Е)

 Общий интермедиат Lys-eN+H2-P--СН2
Общий интермедиат Lys-eN+H2-P--СН2 EрA O- A
EрA O- A

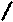


 О
О