|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Натрій бутират; натрій бутаноат
Натрій гексаноат РЕАКЦІЇ НУКЛЕОФІЛЬНОГО ЗАМІЩЕННЯ (SN) У результаті електроноакцепторних властивостей атома Оксигену карбонільної групи атом Карбону карбоксильної групи набуває часткового позитивного заряду і стає електрофільним центром, який може бути атакований нуклеофільним реагентом:
У процесі атаки відбувається заміщення гідроксильної групи на нуклеофільну частинку.
Н28О4 (конц.); і
сн3-с( он Оцтова кислота Етилацетат Реакція естерифікації оборотна. естер, що утворився, у кислому середовищі піддається гідролізу до вихідних кислоти та спирту. Для зміщення рівноваги вбік утворення естеру або використовують надлишок одного з реагентів (як правило, спирту), або видаляють з реакційного середовища воду. Найлегше естери утворюються з первинних спиртів і нижчих карбонових кислот. Вторинні спирти і вищі кислоти реагують повільніше. Третинні спирти через просторові перешкоди вступають у реакцію естерифікації дуже важко. Крім того, під дією мінеральних кислот третинні спирти легко піддаються внутрішньомолекулярній дегідратації з утворенням алкенів (див. с. 326). Каталітична дія сульфатної кислоти полягає в активуванні молекули карбонової кислоти. Механізм естерифікації можна зобразити такою схемою:
,6—н он Г сн3-с он Карбокатіон :О-С2Н5
о—н сн3—с —6—с2н5 :ОНН8+ к. ..••■ СН3—С —О— н н Глава 24 -Н2О; -Н .0
сн3-сч Спочатку карбонова кислота протонується по атому Оксигену карбонільної групи, перетворюючись на карбокатіон, який приєднує молекулу спирту. Далі проміжний продукт відщеплює молекулу води і протон (повернення каталізатора), перетворюючись при цьому в естер. Взаємодіяз галогенуючими реагентами(PCl3, PCl5, PBr3, PBr5, SOCl2). При дії на карбонові кислоти фосфор(III), фосфор(V) галогенідів, тіонілхлориду або інших галогенуючих реагентів утворюються галогенангідриди карбонових кислот: рсі, ,0 сн3—с' + Н3РО3
сн3-с( о он СІ о
сн3-с( сн3-с( Р0С13 5О2Ї НС1 НСН ацетилхлорид; хлорангідрид оцтової кислоти Для добування хлорангідридів частіше використовують тіонілхлорид, тому що в цьому випадку утворюються газоподібні побічні продукти. Галогенангідриди карбонових кислот — досить реакційноздатні речовини, які дуже поширені в органічному синтезі. Утворення ангідридів кислот.Карбонові кислоти при нагріванні в присутності водовіднімаючих засобів фосфор(V) оксиду Р2О5 або трифлуороцтового ангідриду (CF3CO)2O піддаються міжмолекулярній дегідратації з утворенням ангідридів:
сн3-с( сн3-с( о -Н3РО4 сн3-сч СН3-С% оцтовий ангідрид КарБОнОВІ КиСЛОти. мОнОКарБОнОВІ КиСЛОти Взаємодія з амоніаком і амінами.При обробці карбонових кислот амоніаком, первинними або вторинними амінами утворюються амонієві солі, які при нагріванні в сухому вигляді (піроліз) відщеплюють воду і перетворюються в аміди:
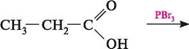
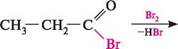
\ \ — он амоній ацетат ацетамід Через жорсткі умови перебігу реакції цей метод утворення амідів рідко використовують з препаративною метою. ЗАМІЩЕННЯ АТОМІВ ГІДРОГЕНУ ПРИ а-АТОМІ КАРБОНУ Завдяки електроноакцепторним властивостям карбоксильної групи (—I-ефект) атоми Гідрогену при а-атомі Карбону набувають рухливості. Так, при обробці карбонових кислот хлором або бромом у присутності каталізатора PCl3 або PBr3 атоми Гідрогену при а-атомі Карбону заміщуються на атом галогену: сн3—сн—соон + вг2 Н Вг пропіонова кислота а-бромопропіонова кислота ця реакція відома як реакція Гелля—Фольгарда—Зелінського. При наявності в а-положенні двох атомів Гідрогену заміщенню може піддаватися один або обидва атоми Гідрогену. Реакція проходить через стадію утворення галогенангідридів кислот, які галогенуються значно легше, ніж самі кислоти:
бромангідрид а-бромопропіонова а-бромопрошонової кислоти кислота ОКИСНЕННЯ ТА ВІДНОВЛЕННЯ Монокарбонові кислоти, за винятком мурашиної, досить стійкі до дії окис-ників. Мурашина кислота легко окиснюється KMnО4 та іншими окисниками з утворенням карбонатної (вугільної) кислоти, яка розкладається на карбон(IV) оксид і воду: НСООН-^->- СО2Ї+ Н2О Монокарбонові кислоти залежно від умов відновлюються до альдегідів або первинних спиртів. Глава 24
Поиск по сайту: |

 електрофільний центр
електрофільний центр Взаємодія зі спиртами (реакція естерифікації). Карбонові кислоти при нагріванні в присутності кислотного каталізатора реагують зі спиртами, утворюючи естери. ця реакція отримала назву «реакція естерифікації»:
Взаємодія зі спиртами (реакція естерифікації). Карбонові кислоти при нагріванні в присутності кислотного каталізатора реагують зі спиртами, утворюючи естери. ця реакція отримала назву «реакція естерифікації»: ОН
ОН Естери карбонових кислот мають однойменні назви (див. Взаємодія зі спиртами).
Естери карбонових кислот мають однойменні назви (див. Взаємодія зі спиртами). /> __ />
/> __ />