 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
АНГІДРИДИ КАРБОНОВИХ КИСЛОТ
Ангідридами називаються похідні карбонових кислот, в яких атом Гідрогену карбоксильної групи заміщений на ацильну групу. Ангідриди є продуктами дегідратації карбонових кислот. Розрізняють лінійні та циклічні ангідриди карбонових кислот:
А
У
Наприклад, ацилування ароматичних вуглеводнів за Фріделем Крафтсом: Лінійні ангідриди, у молекулу яких входять залишки різних кислот, називаються змішаними ангідридами.
НОМЕНКЛАТУРА
Назви ангідридів утворюють від тривіальних назв відповідних кислот, наприклад:
О
!
.
ангідрид малеїнової кислоти, малеїновий ангідрид СПОСОБИ ДОБУВАННЯ Дегідратація карбонових кислот.У присутності сильних водовід-німальних засобів, таких як фосфор (V) оксид, монокарбонові кислоти при нагріванні піддаються дегідратації з утворенням ангідридів: О О
ЗСНзСООН ^^ оцтова кислота Деякі дикарбонові кислоти утворюють ангідриди при нагріванні, наприклад:
Р о + н2о Н2С. Ю—Н
с\;
янтарна (бурштинова) кислота Функціональні похідні карбонових кислот Взаємодія галогенангідридів кислот з безводними солями карбонових кислот.При обробці ацилгалогенідів натрієвими або калієвими солями карбонових кислот утворюються ангідриди. Метод дозволяє одержати як прості, так і змішані ангідриди: О О н3с-< + + _>-сн3 ^^^ с Д >СД КаО^ Н3С/^0/ХСН3 ацетилхлорид натрій ацетат оцтовий ангідрид ФІЗИЧНІ ВЛАСТИВОСТІ Ангідриди карбонових кислот являють собою безбарвні рідини або кристалічні речовини. Нижчі представники гомологічного ряду мають подразнювальний запах. Ангідриди карбонових кислот малорозчинні у воді й повільно з нею реагують. ■ ХІМІЧНІ ВЛАСТИВОСТІ Ангідриди карбонових кислот — досить активні електрофільні реагенти. Однак порівняно з галогенангідридами вони мають менш виражений електрофільний характер, але виявляють більшу елек-трофільність порівняно з карбоновими кислотами: " & електрофільний ---- »- 8+С-»\/**С8+ ■*------ електрофільний центр / \д/ \т, центр К. у к Як і галогенангідриди, ангідриди карбонових кислот легко реагують з різними нуклеофільними реагентами та використовуються для введення в їх структуру ацильних груп. У процесі реакції виділяється молекула карбонової кислоти. Так, при взаємодії з водою ангідриди повільно гідролізуються 3 Утворенням відповідних кислот. Реакція прискорюється при нагріванні: (СН3СО)20 + Н20
При обробці лінійних ангідридів спиртами утворюються естерв
О
(СН3СО)20 + С2Н5ОН Х)С2Н5 етилацетат При дії на лінійні ангідриди амоніаку утворюються аміди карбонових кислот:
о
(СН3СО)20 + гШ3 ацетамід
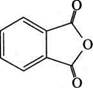
ОКРЕМІ ПРЕДСТАВНИКИ Оцтовий ангідрид (СН3СО)20.Безбарвна рідина з різким запа хом (т. кип. 140 °С), подразнює слизові оболонки очей та дихальних шляхів, спричиняє опіки шкіри. З водою реагує повільно, утворюючи оцтову кислоту, розчиняється в етанолі, етері, бензені, оцтовій кислоті. Застосовується як ацетилувальний реагент у виробництві ацетилцелюлози, вінілацетату, лікарських засобів, наприклад ацетилсаліцилової кислоти. Фталевий ангідрид.Біла кристалічна речовина, легко сублімується, розчинна в етанолі. Використовується в синтезі лікарськ препаратів: фталазолу, фтазину та ін.
Поиск по сайту: |

 Карбонові кислоти. Глава Ц
Карбонові кислоти. Глава Ц
 .
. Карбонові кислоти. Глава і
Карбонові кислоти. Глава і