 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
НОМЕНКЛАТУРА ТА ІЗОМЕРІЯ. У назвах карбонових кислот найчастіше користуються тривіаль-' ною номенклатурою
У назвах карбонових кислот найчастіше користуються тривіаль-' ною номенклатурою. Наприклад, НСООН — мурашина кисле СН3—СООН — оцтова кислота, СН3—СН2—СООН — пропіонов і т. д. Положення замісників відносно карбоксильної групи, в тривіальних назвах позначають грецькими літерами а, (З, у та інші,/ наприклад:
Н2С—СН2—СООН Вг а-метилмасляна кислота р-бромопропіонова кислота За замісниковою номенклатурою ШРАС назви карбонових кислот утворюють від назв відповідних вуглеводнів з тією ж кількістю атомів Карбону, враховуючи і атом Карбону карбоксильної групи, до яких додають суфікс -ов та слово кислота. Нумерацію головного карбонового ланцюга починають з атома Карбону карбоксильної групи: Н—СООН
-СООН СН3—СН—СООН сн3
пропанова кислота 2-метилпропанова кислота Іноді назви карбонових кислот утворюють від назви вуглеводню, що містить як замісник карбоксильну групу, та словосполучення — карбонова кислота, наприклад:
Н3С+-СООН ШзС—СНг-СН2-рСООН ІСНз^ЇН-СООН
пропанкарбонова кислота Цей спосіб застосовують у тих випадках, коли карбоксильна група сполучена з циклічною структурою. За раціональною номенклатурою насичені монокарбонові кислоти розглядають як похідні оцтової кислоти, наприклад:
.................... Н3С
СН3-4СН2—СООН) Назви деяких монок; Назви деяких монокарбонових кислот Формула
Карбонові кислоти. Глава Л Залишок карбонової кислоти, що утворюється після умовно^ вилучення атома Гідрогену від карбоксильної групи, називав
ацилокси-групою К—С^ , а залишок, що утворюється після ві; V няття гідроксильної групи,— ацильною групою К—С . Назви аі оксигруп утворюють від тривіальних латинських назв кисле і суфікса -ат, наприклад:
О
н,с—с
о
ХГ прошонат Назви ацильних груп утворюють від тривіальних латинських назв кислот і суфікса -ил (-іл). За замісниковою номенклатурою ШРАС назви ацильних груп утворюють від назви кислоти, замінюючи суфікс -ова та слово кислота на суфікс -оїл:
■
Ізомерія насичених монокарбонових кислот зумовлена різною структурою вуглеводневого радикала, сполученого з карбоксильною групою. Перші три представники гомологічного ряду не мають ізомерів. Четвертий гомолог існує у вигляді двох структурних ізомерів:
„«аобонові кислоти
н3с-сн2-сн2-соон
масляна кислота Зі збільшенням кількості атомів Карбону в молекулі карбонові кислоти кількість структурних ізомерів різко зростає. 18.1.2. СПОСОБИ ДОБУВАННЯ Існує чимало способів добування карбонових кислот, з яких найважливішими є: Окиснення первинних спиртів і альдегідів (див. розд. 17.4, В.). Первинні спирти окиснюються до карбонових кислот через стадію утворення альдегіду. Як окисник використовують калій дихромат (К2Сг207), КМп04, НМ03 та ін.:
,0
і^ к-с^ первинний спирт Гідроліз гемінальних тригалогенопохідних вуглеводнів. Реакція проходить у кислому або лужному середовищі. Як проміжна сполука утворюється ортокислота, яка відщеплює молекулу води і перетворюється при цьому на карбонову кислоту: о
СІ /И*"
К—С—СІ нонЮН"абоН+)- К—С^гОН,
\л он гем-трихлоралкан Гідроліз нітрилів. При нагріванні штрилш з водними розчина ми кислот і лугів вони піддаються гідролізу з УПЮРенніш ифбшо вих кислот. Як проміжні продукти реакції утворюються аміди кис- лот: КСN _ ' _, НОН(ОН" або Н+)
■ЗквГ *-<>^---------------------- нітрил чш2 он амід карбонової кислоти
\ Карбонові кислоти. Глав Взаємодія магнійорганічннх сполук з С02. При взаємодії маг-нійорганічних сполук (реактивів Гріньяра) з карбон (IV) оксидо*, утворюються солі карбонових кислот, з яких у кислому середов^. щі виділяють відповідні кислоти: О ^ неї . С2Н5—МвСІ + С02------------ С2Н5—С хш^сі етилмагній хлорид ------ с2н5—соон + м8си пропіонова кислота Я Окиснення алканів. Цей метод використовується в промисло-вості для здобування багатьох карбонових кислот. Наприклад прямим окисненням бутану отримують оцтову кислоту: 2С4Н10 + 502 -2Ї-І1*. 4СН3СООН + 2Н20 Гідроліз складних ефірів (естерів). Естери в лужному середовищі гідролізуються з утворенням солей карбонових кислот, які при дії мінеральних кислот перетворюються на карбонові кислоти: ч
ФІЗИЧНІ ВЛАСТИВОСТІ Нижчі карбонові кислоти (з кількістю атомів Карбону не більше трьох) за звичайних умов являють собою рухливі рідини з гострий запахом. Кислоти з С4—С9 — маслянисті рідини з неприємним запахом, що нагадує запах поту. Карбонові кислоти з кількістю атомів Карбону Сш і вище — тверді речовини. Мурашина, оцтова та про* піонова кислоти змішуються з водою в будь-яких співвідношення» Зі збільшенням молекулярної маси кислоти розчинність її у воді ДУ#* зменшується. Вищі карбонові кислоти нерозчинні у воді. Темпера" тури кипіння кислот значно вищі за температури кипіння спирті» з тією ж самою кількістю атомів Карбону (табл. 18.2). Це свідчить про те, що кислоти більш асоційовані, ніж спирти. На відміну від спяр" тів, для яких характерні тільки лінійні асоціати, карбонові кислоти внаслідок утворення міжмолекулярних водневих зв'язків утворюкй* як лінійні, так і циклічні асоціати у вигляді димерів: - 285
С с Таблиця 18.2 Фізичні константи деяких насичених монокарбонових кислот
Формула НСООН
н3с—соон сн3сн2соон сн3сн2сн2соон н3с—сн—соон сн3 СН3СН2СН2СН2СООН н3с—сн—сн2соон І СН3 СН3(СН2)4СООН СН3(СН2)14СООН СН3(СН2)16СООН
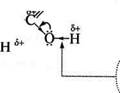
ХІМІЧНІ ВЛАСТИВОСТІ Реакційна здатність карбонових кислот визначається наявністю в їх структурі карбоксильної групи. Карбоксильна група являє собою спряжену систему, в якій неподілена пара електронів атома Оксигену гідроксильної групи вступає в спряження з л-електрона-Ми карбонільної групи (р,я-спряження). Електронна густина в спряженій системі зміщена в бік атома Оксигену карбонільної ^С=0 групи, неподілені пари електронів якого не беруть участі в спряженні. Унаслідок зміщення електронної густини зв'язок О—Н виявляється сильно поляризованим, що приводить до появи в карбок-
Карбонові кислоти. Глава Щ сильної групи ОН-кислотного центру. Але в той же час за рахунок групи —ОН у молекулах карбонових кислот дещо зменшується! частковий позитивний заряд на атомі Карбону карбонільної гру-їпи порівняно з альдегідами та кетонами. Крім того, внаслідок -/-ефекту карбоксильної групи в молекулі карбонової кислоти відбувається зміщення електронної густини вуглеводневого залишку, що приводить до появи С—Н-кислотного центру при а-карбонот,] вому атомі:
,_ ч:
ОН-кислотний центр Виходячи з наведеної будови карбонових кислот, основні їх реакції можна умовно розподілити на чотири групи: А. За участю зв'язку О—Н (кислотні властивості); Б. Реакції нуклеофільного заміщення за участю атома Карбону карбонільної групи; В. Заміщення атомів Гідрогену при а-карбоновому атомі; Г. Окиснення та відновлення.
Поиск по сайту: |







 ------------- --------------------------------- !-----------------
------------- --------------------------------- !-----------------

 | '..а
| '..а