 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ЕНЕРГЕТИЧНІ УМОВИ ПЕРЕБІГУ РЕАКЦІЙ
Можливість перебігу тієї чи іншої реакції визначається не тільки хімічною природою реагуючих молекул, але і низкою інших чинників, серед яких важливе значення мають енергетичні. Оскільки будь-яка система прагне, як відомо, до стану з найменшою можливою потенційною енергією, реакція може здійснюватися лише за умови, якщо вільна енергія вихідних речовин Gвих більша від вільної енергії кінцевих продуктів Gкін реакції, тобто коли зміна вільної енергії АС від'ємна (рис. 8.1).
Однак від'ємна величина АС необхідна, але недостатня умова для самовільного перебігу реакції. Звичайно на шляху до продуктів реакції молекулам вихідних речовин доводиться долати енергетичний бар'єр, названий енергією активації Еа (рис. 8.2).
А + В—C ------ 9 А—B + C у міру
зближення атома А з молекулою В—С відбувається ослаблення зв'язку В—С і одночасно починає формуватися зв'язок між атомами А і В. У результаті утворюється активований комплекс А---В---С, в яко- ОСнОВи теОрІЇ реаКЦІЙ ОрГанІЧних СПОЛУК му унаслідок перерозподілу електронної густини атом В однаковою мірою зв'язаний з атомами А і С. Активований комплекс перебуває в стані рівноваги з вихідними реагентами, а потім при подальшому зменшенні відстані між атомами А і В синхронно перебігають процеси утворення зв'язку А—В і розриву зв'язку В—С: А + В—С
*: [А—В—С] * активований комплекс (перехідний стан) Характер перехідного стану визначає селективність (вибірковість) перебігу реакції в будь-якому одному переважному напрямі з кількох можливих. Чим стабільніший перехідний стан, тим менша енергія активації, а чим менша енергія активації, тим вища швидкість реакції.
Двостадійний процес характеризується наявністю двох перехідних станів, яким відповідають енергетичні максимуми Ea1 і Ea2, а також проміжного продукту.
Стадію реакції, перехідний стан якої має найвищу енергію активації, називають лімітуючою стадією.
ця стадія проходить з нижчою швидкістю і визначає швидкість реакції в цілому, тому часто її називають швидкістьвизначальною стадією. Западина (провал) на кривій потенційної енергії відповідає проміжному продукту. На відміну від активованого комплексу проміжний продукт є реально існуючою сполукою з досить високою потенційною енергією. Час життя інтермедіату залежить від глибини западини на енергетичній діаграмі. якщо «провал» між двома перехідними станами виражений досить чітко, проміжний продукт можна реально виділити. Частіше інтермедіат існує короткий час, тому що завдяки високій реакційній здатності при невеликій енергії активації (E2) він через перехідний стан 2 перетворюється в кінцевий продукт реакції. В органічних реакціях як інтермедіати найчастіше виступають карбокатіони, карбаніони, вільні радикали і с-комплекси. Докладніше енергетичні і кінетичні умови перебігу реакцій розглядаються в курсі фізичної хімії.
Поиск по сайту: |

 енергія активації необхідна для здійснення активних зіткнень реагуючих молекул, тобто зіткнень, які призводять до хімічної взаємодії. Максимум на енергетичній діаграмі реакції (див. рис. 8.2) відповідає так званому перехідному стану, або активованому комплексу. Перехідний стан являє собою гранично нестійке сполучення реагуючих молекул, яке утворюється внаслідок перерозподілу електронної густини хімічних зв'язків у молекулах реагентів при їхньому зближенні. У реакції
енергія активації необхідна для здійснення активних зіткнень реагуючих молекул, тобто зіткнень, які призводять до хімічної взаємодії. Максимум на енергетичній діаграмі реакції (див. рис. 8.2) відповідає так званому перехідному стану, або активованому комплексу. Перехідний стан являє собою гранично нестійке сполучення реагуючих молекул, яке утворюється внаслідок перерозподілу електронної густини хімічних зв'язків у молекулах реагентів при їхньому зближенні. У реакції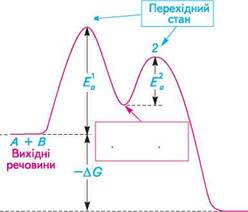 Для дво- або багатостадійних реакцій характерне утворення не лише активованих комплексів, але і проміжних сполук (інтермедіатів)1. Реакція, яка проходить у дві стадії (рис. 8.3), становить власне кажучи дві окремі реакції.
Для дво- або багатостадійних реакцій характерне утворення не лише активованих комплексів, але і проміжних сполук (інтермедіатів)1. Реакція, яка проходить у дві стадії (рис. 8.3), становить власне кажучи дві окремі реакції.