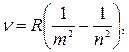|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Спектр атома водорода по Бору
Найдем вначале радиус n-й стационарной орбиты электрона. При движении электрона по окружности радиуса r ни него действует центростремительная сила mv2/2, в качестве которой выступает сила кулоновского взаимодействия ядра и электрона
где e — заряд электрона. Исключая из уравнений (29.24) и (29.26) скорость v, получаем радиус n-й электронной орбиты
Найдем теперь полную энергию атома водорода:
где Wk, Wp — соответственно кинетическая и потенциальная энергия электрона. Использовав соотношение (29.26), запишем
Потенциальную энергию электрона найдем как произведение заряда электрона на потенциал электростатического поля, создаваемого ядром:
Здесь знак «–» учитывает, что потенциальная энергия взаимодействия электрона и ядра является энергией притяжения. Подставляя (29.29) и (29.30) в (29.26), получаем полную энергию атома водорода
И наконец, подставим в (31) значение радиуса орбитыиз (27):
где n=1, 2, … . Видно, что энергия атома может принимать лишь дискретные значения. Используя второй постулат Бора, найдем частоту фотона, испускаемого при переходе атома водорода из стационарного состояния nбольшей энергией в состояние m с меньшей энергией:
где R — постоянная Ридберга;
Формула (33) совпадает с обобщенной формулой Бальмера (23), установленной экспериментально на основании анализа спектра излучения водорода. В этом спектре различными авторами были выделены серии, в которых положение спектральных линий в шкале частот подчиняется определенным закономерностям. Как следуетиз теории Бора, каждая из серий получается из формулы (33) при определенном фиксированном значении числа т и значениях n, равных m+1, m+2, … : серия Лаймана
серия Бальмера
серия Пашена
серия Брэкета
серия Пфунда
Схема переходов, приводящих к возникновению серий в спектре излучения атома водорода, показана на рис, 8. Заметим, что линии серии Лаймана расположены в ультрафиолетовой, серии Бальмера — в видимой, а линии остальных серий — в инфракрасной части спектра, Объяснение линейчатого спектра излучения и поглощения атома водорода и других водородоподобных атомовНе+, Li+и т.д. являлась блестящим успехом теории Бора. Однако в дальнейшем были обнаружены принципиальные трудности, которые невозможно было преодолеть в рамках этой теории: теория Бора внутренне противоречива: она не была ни последовательно классической, ни последовательно квантовой теорией; она оставляла открытым вопрос об интенсивности спектральных линий; попытки применить эту теорию к многоэлектронным атомам не увенчались успехом.
Рис. 8 Тем не менее, в историческом плане теория Бора сыграла свою положительную роль как промежуточный этап на пути к последовательной квантовой теории атомных явлений.
Лекція 40. Корпускулярно-хвильовий дуалiзм. Гiпотеза де Бройля. Спiввiдношення невизначеностей. Хвильова функцiя та її статистичний змiст.
Поиск по сайту: |