 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Химико-алгебраическое уравнение как модель реакции
Если известны формулы реагирующих веществ и продуктов реакции, то для составления химического уравнения достаточно правильно определить стехиометрические коэффициенты. В простейших случаях их можно вычислять арифметически и всегда с помощью составления и решения системы линейных алгебраических уравнений. Рассмотрим пример, соответствующий схеме:
Вычислим, сколько моль
которое назовем химико-алгебраическим.Теперь на основе атомного баланса составим систему алгебраических уравнений
которая во множестве вещественных чисел имеет единственное решение:
Теперь очевидно, что: если в уравнении химической реакции один (любой) из коэффициентов выбран равным 1 (или другому числу), а остальные при этом найдены ОДНОЗНАЧНО во множестве вещественных чисел только на основе атомного баланса, то рассматриваемое уравнение составлено правильно. Конечно, в уравнении (4.3) можно все коэффициенты умножить на наименьшее общее кратное их знаменателей и записать его с целыми коэффициентами, которые являются взаимно простыми натуральными числами
Если же соответствующая система алгебраических уравнений, составленная только на основе атомного баланса, окажется неопределенной, т.е. будет иметь более одного решения, то для однозначного нахождения коэффициентов необходима дополнительная информация. Так, если для схемы Ag + О3→ Ag2О +О2↑ сначала запишем химико-алгебраическое уравнение в виде
и составим только на основе атомного баланса систему
то легко обнаружим, что она оказалась неопределенной. Но окислительные свойства озона обусловлены образованием атомарного кислорода в соответствии с уравнением: О3 = О + О2 , а это означает, что в реальной реакции из каждой молекулы озона О3 образуется одна молекула О2 кислорода, т.е. коэффициенты при О3 и О2 должны быть равны. Теперь дополнив уравнением 2Ag + О3= Ag2О +О2↑. (4.6) Но как отмечено выше, коэффициенты для простых уравнений можно определять арифметически, без составления и решения системы алгебраических уравнений. Но однозначность легче устанавливается с помощью системы линейных алгебраических уравнений непосредственным её решением или, методами высшей алгебры, не решая систему. Так, для схемы, соответствующей записи (4.6) определим, сколько моль Ag реагирует с одним моль О3 и сколько моль Ag2О и О2 при этом образуется, т.е. считая коэффициент при О3 равным 1, вычислим остальные. При этом коэффициент при О2 , как указано выше, равен коэффициенту при О3, т.е. 1, а тогда на основе атомного баланса находим коэффициент при Ag2О, который равен 1 и, наконец, вычисляем коэффициент при Ag и находим, что он равен 2. Таким образом, считая коэффициент при О3 равным 1, остальные найдены, на основе химизма реакции и атомного баланса, однозначно! Следовательно, химическое уравнение (4.6) составлено правильно! В итоге сформулируем критерий истинности химических уравнений, моделирующих реальные реакции, в виде: Если в химическом уравнении один (любой) из коэффициентов выбран равным 1 (или другому числу), а остальные при этом найдены (на основе закона сохранения массы, механизма реакции или другой объективной информации) ОДНОЗНАЧНО во множестве вещественных чисел, то рассматриваемое уравнение составлено правильно. В этой связи отметим, что в учебнике [Буринская Н.Н., Величко Л.П. Химия 10 кл. – К.– 2003, c. 16] ошибочно подобраны коэффициенты и записано химическое уравнение: 8Ag + 2О3= 4Ag2О + О2↑, которое противоречит свойствам озона, описанным в этой же книге. Коэффициенты надо не подбирать, а определять, вычислять! В этом уравнении они формально подобраны так, что количества атомов Ag и О в левой и правой частях равенства одинаковы, однако это условие является необходимым для составления правильного уравнения, но не достаточным. Сравните, например, два утверждения: чтобы окончить университет, необходимо в него поступить, и чтобы окончить университет, достаточно в него поступить. Ясно, первое их них верно, второе – нет. Не все, поступившие в университет, его оканчивают. Итак, поступление в университет является лишь необходимым условием того, чтобы его окончить! Часто коэффициенты химических уравнений правильно находят с помощью подбора только благодаря тому, что в таких уравнениях при фиксированном коэффициенте, не обязательно равном 1, при формуле одного вещества, остальные, в силу самой схемы химической реакции, определяются однозначно только на основе атомного баланса. Но ведь заранее неизвестно, определены ли в указанных условиях коэффициенты однозначно или нет. Вот почему ОДНОЗНАЧНОСТЬ, о которой идет речь, должна быть обоснована! Конечно, при определении коэффициентов в химических уравнениях нет необходимости составлять систему алгебраических уравнений со многими неизвестными: почти всегда достаточно одного уравнения или системы двух уравнений, решения которых рассматриваются даже в гуманитарных классах средней в школы. Теперь рассмотрим задачу (Вивюрский В.Я. Учись приобретать и применять знания по химии/ - М.: Просвещение, 1987, С. 78 – 79). Для нейтрализации серной кислоты массой 49 г был взят гидроксид натрия массой 20 г. Какова масса образовавшейся соли? Авторское решение этой задачи и ответ – «Образуется Nа2SО4массой 35,6 г» – ошибочны.Такое решение соответствует гипотезе, состоящей в том, что в результате реакции образуется только средняя соль, тогда как средняя соль не единственная, которая может получиться при взаимодействии гидроксида натрия и серной кислоты. В конечных продуктах может образоваться кислая соль, а также смесь средней и кислой солей и эта возможность должна быть отражена в схеме реакции. Кроме того, исходные вещества могут прореагировать полностью, а может одно из веществ оказаться в избытке. Посмотрим, какая из этих двух возможностей имеет место. Сначала рассмотрим возможность полного реагирования. Количество вещества серной кислоты в 49 г её будет: n(Н2SО4) = 49 г/(98 г/моль) = 0,5 моль. Аналогично n(NаОН) = (20/40) моль = 0,5 моль. Исходя из них, на основе системного подхода, запишем химико-алгебраическое уравнение 0,5 Н2SО4 + 0,5 NаОН → хNа2SО4 +у NаНSО4 + zН2О, в котором коэффициенты в левой части известны. Поскольку выясняется возможность полного реагирования, х≥0,у≥0и х+у>0,т.е. хотя бы одно из этих неизвестных положительно. В этих условиях, коэффициент при Н2О однозначно определяется по кислороду гидроксильных групп щёлочи NаОН, т.е. z = 0,5. после чего остальные однозначно вычисляются на основе атомного баланса: х = 0, у = 0,5 (кстати, если на основе баланса атомов Nа и S составить систему с неизвестными х и у и решить её, то получится тот же результат). Значит, имеет место полное реагирование, и химическое уравнение принимает вид: 0,5Н2SО4 + 0,5 NаОН = 0,5 NаНSО4,+ 0,5Н2О, из которого следует, что масса кислой соли, образовавшейся в результате реакции, будет: 0,5∙ (23+1+32 +16∙4) = 60 (г). Этот ответ отличается от авторского не только количественно, но и качественно, так как в результате реакции образуется только кислая соль. Вывод. Однозначность стехиометрических коэффициентов, при фиксированном значении одного из них, является надежным критерием истинности и коэффициентов, и химического уравнения. Действительное изображается в мышлении не в целых числах, а в дробях. Л. Фейербах
Поиск по сайту: |
 +
+  →
→ 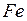 +
+  . (4.1)
. (4.1) ,
,  и
и  , из уравнения
, из уравнения +
+  →
→  +
+  . (4.2)
. (4.2) ,
, , а потому уравнение (4.2) примет вид:
, а потому уравнение (4.2) примет вид: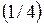

 +
+ 
 . (4.4)
. (4.4) ,
,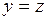 выписанную выше систему и решив её, получим однозначный ответ:
выписанную выше систему и решив её, получим однозначный ответ: