 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Диссоциация водяного пара и углекислоты.
Диссоциация водяного пара. При высоких температурах было обнаружено разложение водяного пара, причём полного разложения не происходит, а процесс распада идёт до некоторого предела. Таким образом, диссоциация водяного пара при высоких температурах объясняется наступлением равновесия:
2 Н
Диссоциированное количество водяного пара, выраженное в долях от исходного его количест- ва, называется – степенью диссоциации и обозначается через Пусть число молей водяного пара до диссоциации равняется 2. После диссоциации в состоянии равновесия при данной температуре смесь будет состоять из: H H O ______________________ Всего: (2 +
Тогда парциальные давления будет:
Р
где: V- общий объём. Применяя закон действующих масс, получаем:
k
Заменив общий объём общим давлением Р, определённым из уравнения состояния:
PV = (2 +
получим соотношение между общим давлением и степенью диссоциации:
k
Из уравнения (2) следует, что при постоянной температуре с возрастанием давления степень диссоциации водяного пара убывает.Согласно принципу Ле – Шателье: Принцип Ле – Шателье: при увеличении избытка одного из продуктов диссоциации степень диссоциации понижается, с повышением температуры степень диссоциации увеличивается. При топочных температурах (ниже 2000 Таким образом, в топочных процессах значение диссоциации невелико. При обычных топоч - ных температурах, не превышающих 1600-1700
Диссоциация углекислоты. Разложение углекислоты, обнаруженное при высоких температурах. было объяснено установлением равновесия 2 СО + О При атмосферном давлении диссоциация СО В случае топочных процессов парциальное давление углекислоты в продуктах сгорания невелико, составляет 10 – 20 кПа (0,1 – 0,2кгс/см
Поиск по сайту: |
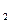 + О
+ О 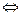 2 Н
2 Н  .
. =
=  Р
Р  =
= 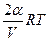 Р
Р  =
= 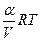
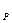 =
= 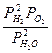 =
= 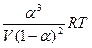
 (2)
(2) С) равновесие 2 Н
С) равновесие 2 Н 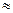 0,14%, при температуре 2227
0,14%, при температуре 2227  4%, а при 2512
4%, а при 2512  ), поэтому степень диссоциации СО
), поэтому степень диссоциации СО