 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Основы теории цепных реакций.
Экспериментально установлено, что большинство реакций протекает через промежуточ -ные этапы. Большей частью активными промежуточными продуктами являются – свободные радикалы или атомы. Реакция совершается между активными промежуточными продуктами и исходными веществами, причём наряду с конечными продуктами вновь образуются активные промежуточные продукты, которые обеспечивают дальнейшее протекание реакции. Подобные реакции называются – цепными реакциями. Основы теории цепных реакций были разработаны Н.Н.Семёновым и К Хиншельвудом. В цепных реакциях различают следующие процессы:
Если при некоторых условиях (Т и р ) скорость разветвления цепей превышает скорость их обрыва, то концентрация активного продукта и скорость реакции со временем прогрессивно возрастает, нестационарное протекание реакции. Такая реакция называется – разветвленной цепной реакцией. Критическое явление перехода от стационарного режима к нестационарному называется - воспламенением. Цепная реакция также может продолжаться, если молекула активного продукта, реагируя с исходными веществами, вызывает образование конечных продуктов и одной молекулы активного продукта. В этом случае концентрация активного продукта остаётся постоянной и равной равновесному значению его. Такие реакции называются – неразветвлёнными цепными реакциями.
5.4. Неразветвлённые цепные реакции.
Примером неразветвлённой цепной реакции будет: Н Вследствие диссоциации молекул СI и при столкновениях между собой или с другими молекулами М в системе Н
Сl
Атомы CI реагируют с Н При реакции (2) одновременно с образованием HCI образуется ещё атом водорода, который реагирует по реакции: H + Cl
со скоростью, больше чем реакция уравнения (2). Таким образом, в результате реакций (2) и (3) любой атом CI, вызвавший реакцию, вновь восстанавливается после образования двух молекул HCI. Восстановленный атом хлора опять вступает в реакцию (2) и т.д.
Поиск по сайту: |
 зарождение цепей - образование активного продукта из исходных веществ при столкнове -ниях их активных молекул или под влиянием света или других факторов активации;
зарождение цепей - образование активного продукта из исходных веществ при столкнове -ниях их активных молекул или под влиянием света или других факторов активации;
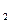 +СI
+СI 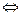 2 Cl + M (1)
2 Cl + M (1)