 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Скорость химических реакций. Зависимость скорости реакции от температуры.
Скоростью гомогенной реакции – называется количество вещества, реагирующего в единице объёма за единицу времени, т.е. изменение концентрации одного из компонентов реагирующих веществ за единицу времени. Скоростью гетерогенной реакции – называется количество веществ, реагирующего на единицу поверхности за единицу времени. Скорость газовой реакции:
можно выразить как через скорость образования одного из продуктов реакции:
+
- dn
Относя уравнение (2) к единице объёма и единице времени, получаем:
Аналогично можно получить соотношение между скоростью расходования вещества А и скоростью образования вещества М:
Следовательно, между изменениями концентраций реагирующих веществ существует следую -щая связь:
т.к. стехиометрические коэффициенты Константа скорости реакции k характеризует собой скорость химической реакции при данной температуре. Значит, для нахождения зависимости скорости химической реакции от температуры достаточно определить температурную зависимость k. При изучении химических реакций было замечено, что если откладывать ln k как функцию обратной величины от абсолютной температуры, то опытные данные ложатся на прямой линии. Поэтому была предложена зависимость константы скорости от температуры в виде:
ln k = - или в дифференциальной форме:
и в экспоненциальной форме: k = k
где: Е и k R= 8,321 кДж/моль К – универсальная газовая постоянная; Т – абсолютная температура.
5.2. Энергия активации, закон Аррениуса.
Реагировать способны не все молекулы, а лишь молекулы, находящиеся в данный момент в особом (богатом энергией) состоянии, которые были названы – “ активными молекулами.” Активные молекулы образуются эндотермически из нормальных молекул. Процесс, при котором изменяется энергия молекул без химического превращения, называется – активацией, а теплота, поглощаемая при образовании активных молекул, называется – теплотой активации. Между нормальными и активными молекулами существует равновесие. Константа этого равно- весия и является величиной, обладающей большим температурным коэффициентом. Если теплота (энергия) образования активных молекул равна Е, то температурная зависимость константы равновесия K
где: C С
Концентрация нормальных молекул будет определяться:
Предполагается, что концентрация активных молекул очень мала по сравнению с концен -трацией нормальных молекул, поэтому концентрацию последних можно считать постоянной. Тогда получим:
т.к. константа скорости реакции k пропорциональна концентрации активных молекул, то:
(1)
Уравнение (1) - уравнение температурной зависимости константы скорости реакций. Зависимость (1) представляет собой – закон Аррениуса: логарифм скорости реакции как функция от Закону Аррениуса, имеющему энергетическое происхождение, было дано два объяснения: 1) термодинамическое 2) статистическое. 1) Возьмём обратимую реакцию: А +В где: k k Тогда по уравнению (5) параграфа 5.1 имеем:
Но ln k = ln k
Таким образом, от уравнения температурной зависимости константы равновесия мы перешли к уравнению Аррениуса. Кроме этого, видно что тепловой эффект реакции равен разности между энергией активации продуктов реакции Е Энергия активации представляет собой главный фактор, определяющий скорость реакции: чем меньше энергия активации, тем быстрее протекает реакция. 2) Для наступления реакции прежде всего необходимо столкновение реагирующих молекул. Однако число столкновений молекул при данных температуре и давление, вычисленное на основании кинетической теории, как показывают опыты в много миллионов раз больше числа молекул, вступающих в реакцию. Значит в реакцию вступают только активные молекулы. Из закона распределения Максвелла-Больцмана ( рис.1) видно, что в газе имеется небольшое количество молекул с очень большими, а также и очень малыми значениями скоростей. Для химической реакции представляют интерес только молекулы с очень большими скоростями, обладающие повышенной энергией. Число молекул, обладающих энергией, равной или больше Е, равно:
N =
где: dN - число молекул, обладающих скоростями между W и W + Dw, согласно закону распределения:
dN =
где: N
Повышение температуры оказывает очень благоприятное действие на процесс активации: сильно увеличивается число молекул, обладающих большой энергией, тогда как общая энергия увеличивается в слабой степени, т.е. происходит перераспределение энергии. Отсюда ясно, что большой температурный коэффициент скорости реакции объясняется большим температурным коэффициентом активации. Возвращаясь к уравнению (6) параграфа 5.1, можно его упрощённо толковать так, что k
Поиск по сайту: |
 А +
А + 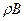
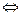
 +
+ 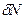 (1)
(1)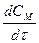 или +
или + 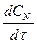 так и через скорость расходования какого-либо исходного вещества:
так и через скорость расходования какого-либо исходного вещества: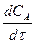 или -
или - 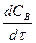 . Согласно уравнению (1) каждые
. Согласно уравнению (1) каждые 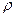 молями вещества В, то в течении времени d
молями вещества В, то в течении времени d  расходуется dn
расходуется dn 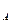 молей вещества А, при этом вещество В расходуется в количестве:
молей вещества А, при этом вещество В расходуется в количестве: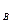 =
= 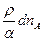 (2)
(2)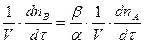 или
или 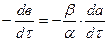
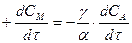

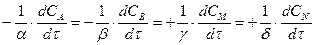 (3)
(3)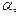
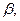
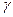 и
и 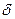 являются постоянными величинами, то скорость реакции можно определить по скорости превращения любого из реагентов. Поэтому скорость сгорания топлива можно выразить через скорость расходования горючих элементов, скорость расхождения окислителя или скорость образования продуктов сгорания.
являются постоянными величинами, то скорость реакции можно определить по скорости превращения любого из реагентов. Поэтому скорость сгорания топлива можно выразить через скорость расходования горючих элементов, скорость расхождения окислителя или скорость образования продуктов сгорания.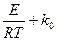 (4)
(4) (5)
(5)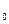 e
e 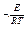 (6)
(6) - эмпирические константы;
- эмпирические константы;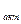 =
= 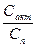
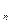 - концентрация нормальных молекул будет.
- концентрация нормальных молекул будет.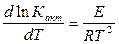
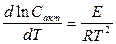
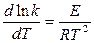
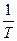 изображается прямой линией. Угол наклона этой прямой определяет энергию активации.
изображается прямой линией. Угол наклона этой прямой определяет энергию активации.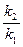
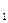 - константа скорости прямой реакции,
- константа скорости прямой реакции,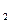 - константа скорости обратной реакции.
- константа скорости обратной реакции.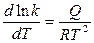
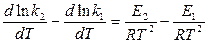
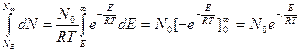 (2)
(2)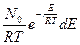 (3)
(3) (4)
(4)