 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Стационарная теория теплового самовоспламенения.
Скорость химической реакции с ростом температуры увеличивается прогрессивно соглас -но закону Аррениуса, поэтому тепловыделение в единицу объёма выражается экспоненциаль -ной кривой: Q где: k С – концентрация горючего газа; n – порядок реакции; Q – теплота сгорания. Теплоотдача, отнесенная к единице объёма, является линейной функцией от температуры:
Q
где: F – поверхность сосуда; V – объём сосуда, в котором находится горючая смесь. Т – температура реагирующей смеси, принимая одинаковой во всём реакционном объёме. Т Стационарными режимами являются точки пересечения кривых Q Значит, нижний стационарный режим является устойчивым и характеризуется слабым разогревом, малой скоростью реакции. При разогреве смеси выше температуры, соответствующей т. 2, тепловыделение превышает теплопотери, в результате происходит прогрессивный разогрев, приводящий к самовоспламе -нению. При понижении температур тепловыделение Q Будем теперь повышать температуру окружающей среды Т Данный метод исследования, в котором возможность наступления самовоспламенения рассматривается как достижение предельно возможного стационарного состояния, являющего- ся критическим, получил название стационарной тепловой теории самовоспламенения. Разность температур Стационарная теория имеет большое значение для выявления физико-химической сущности процесса самовоспламенения, но она не предназначена для расчетов форсированных топливо -сжигающих устройств с весьма малым периодом индукции. В условиях сжигания топлив в камерных топках парогенераторов, в камерах сгорания газотурбинных установок (ГТУ) и в других форсированных устройствах период индукции ограничивается величиной порядка сотых долей секунды и поэтому в этих случаях следует пользоваться теорией теплового самовоспламенения.
Поиск по сайту: |
 = k
= k 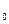 e
e 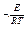 C
C  Q (1)
Q (1) =
=  (2)
(2) - коэффициент теплоотдачи;
- коэффициент теплоотдачи; - температура стенок сосуда, равная температуре окружающей среды.
- температура стенок сосуда, равная температуре окружающей среды.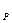 , в которых тепловыделение равняется теплопотерям. На рис.1 изображена зависимость тепловыделения Q
, в которых тепловыделение равняется теплопотерям. На рис.1 изображена зависимость тепловыделения Q 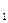 , она вновь охладится до той же температу- ры. В этом случае реакция приводит к разогреву смеси до температур Т 1, которая несколько выше, чем температура стенок сосуда Т
, она вновь охладится до той же температу- ры. В этом случае реакция приводит к разогреву смеси до температур Т 1, которая несколько выше, чем температура стенок сосуда Т  кривые Q
кривые Q  мы имеем стационарный режим, напротив, незначительное превыше- ние температуры окружающей среды над Т
мы имеем стационарный режим, напротив, незначительное превыше- ние температуры окружающей среды над Т  называется – предвзрывным разогревом. Итак, температура самовоспламенения зависит не только от природы и свойств горючей смеси, но и от условий протекания процесса, определяющих теплоотдачу реагирующей смеси, и поэтому не является физико-химической константой, а представляет собой результативную характеристику процес- са. Таким образом, в стационарной тепловой теории определяется состояние смеси на пределе самовоспламенения, которое является возможным предельным стационарным состоянием.
называется – предвзрывным разогревом. Итак, температура самовоспламенения зависит не только от природы и свойств горючей смеси, но и от условий протекания процесса, определяющих теплоотдачу реагирующей смеси, и поэтому не является физико-химической константой, а представляет собой результативную характеристику процес- са. Таким образом, в стационарной тепловой теории определяется состояние смеси на пределе самовоспламенения, которое является возможным предельным стационарным состоянием.