 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Химическое равновесие и закон действующих масс.
В зависимости от характера протекающих при горении топлива физико-химических явлений различают гомогенное и гетерогенное горение. При гомогенном горении топливо и окислитель находятся в газообразном, т.е. в одинаковом фазовом состоянии; при гетерогенном – реакции протекают между веществами, имеющими различное агрегатное состояние ( например, горение кокса в потоке воздуха). Опыты показывают, что химические реакции никогда не происходят до полного превра -щения исходных веществ, а обычно протекают лишь до определённого предела и затем как бы останавливаются. В этот момент наряду с продуктами реакции в системе присутствует некото -рое количество начальных и промежуточных веществ, что объясняется одновременным проте - канием реакции в двух противоположных направлениях: как в сторону образования конечных продуктов, так и в сторону образования исходных веществ в результате реагирования конечных продуктов. Протекание реакции в двух противоположных направлениях называется – химической обратимостью и записывается стехиометрическим уравнением в виде:
где: А,В,М,N – химические символы реагирующих веществ;
По мере протекания процесса вследствие уменьшения количества исходных веществ пря -мая реакция идёт всё медленнее, скорость же обратной реакции увеличивается, т.к. продукты прямой реакции все прибывают. Наконец, при определённой температуре наступает такой момент, когда скорости прямой и обратной реакций уравновешиваются. В этом случае говорят о наступлении – химического равновесия, при котором в одно и то же время образуется столько продуктов, сколько их распадается. Скорость протекания химических реакций и положение равновесия зависит от химичес - кой природы реагирующих веществ, концентраций реагирующих веществ, физических услo -вий, т.е.температуры, давления, объёма. Наступление химического равновесия данной реакции при постоянных температуре и давлении зависит от концентраций реагирующих веществ. Эта зависимость определяется на основе закона действующих масс. Закон действующих масс: B однородной среде при постоянной температуре скорость реакции пропорциональна произведению концентраций реагирующих веществ. Согласно закону действующих масс скорость прямой реакции в любой момент времени выражается уравнением:
W
т.к. реакция химически обратима, то конечные продукты М и N реагируют, образуя исходные вещества А и В. Скорость обратной реакции зависит от концентрации веществ М и N и равняется: W
где: С
При равновесии: W
Отношение:
где: k
Уравнение (4) представляет собой математическое выражение закона действующих масс. Итак, при заданной температуре равновесие в рассматриваемой реакции наступает при определённом соотношении концентраций реагирующих веществ, поэтому величина k
k
Из уравнения состояния для каждого газа, входящего в смесь:
P
получаем: P
где: C
C
В формулах (6) и (8): P V - общий объём смеси; n Выразив молярные концентрации реагирующих веществ в уравнении (4) через их парциальные давления согласно (8), получим:
k
где: Из уравнения (9) видно, что константы равновесия k
Поиск по сайту: |
 А +
А + 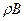
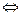
 +
+ 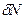 (1)
(1)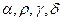 - стехиометрические коэффициенты.
- стехиометрические коэффициенты.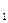 =
=  C
C 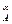 C
C  (2)
(2)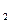 =
= 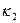 C
C 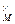 C
C  (3)
(3)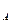 , С
, С 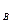 , С
, С  , С
, С  - текущие концентрации реагирующих веществ, моль/м
- текущие концентрации реагирующих веществ, моль/м 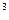 .
. =
= 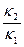 = k
= k 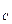 (4)
(4)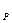 =
=  (5)
(5)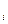 V = n
V = n 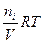 = C
= C 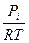 (8)
(8) (9)
(9)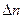 =
= 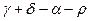 - изменение числа молей газов в результате реакции.
- изменение числа молей газов в результате реакции.