 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ПОВРЕЖДАЕМОСТЬ ОТ ВОЗДЕЙСТВИЯ ОКРУЖАЮЩЕЙ СРЕДЫ
За исключением разрушений, происходящих при высокотемпературном окислении, коррозия металлов, находящихся в контакте с жидкими средствами, является электрохимическим процессом. В этом процессе участвуют: Анод – участок, на котором происходит потеря (растворение) металла; Катод – участок, на котором металл не разъедается; Электролит – коррозионная среда, в которой развивается процесс. На анодных участках коррозирующих металл происходит в раствор электролита в виде положительно заряженных ионов. Рис. 2.26.
металла, микронесплошностей в ЛКП, аэрации электролита, конденсации, адсорбции. Скорость коррозии зависит от электропроводной среды (мин.в дист. воде.) В процессе коррозии происходит окисление металла с образованием окислов. Коррозийная стойкость металла зависит от Металлы с большим отрицательным потенциалом коррозируют довольно быстро, тогда как металлы с большим положительным электродным потенциалом отличаются высокой коррозийной стойкостью. (Магний, цинк, алюминий, кадмий – большой отрицательный потенциал; Дуралюмин, малоуглеродистая сталь, чугун, нержавеющая сталь, свинец, олово, никель, латунь, медь, бронза – нейтральны; Серебро, титан, золото, платина – положительный потенциал). Ржавление железа – это окисление с образованием оксидных производных – FeO, Fe2O3, Fe3O4. На следующей стадии происходит замыкание электрической цепи в среде электролита, на поверхности образуется ржавчина. Этот процесс многократно повторяется до образования сквозных язвин. По условиям протекания и по характеру повреждения конструкции можно выделить следующие типы коррозии металлов: Ø Гальваническая (контактная) – при контакте двух или более металлов с различными электродными потенциалами; Ø Питтинговая – местное разрушение металлов на небольшую глубину; Ø Межкристаллитная – формируется по границам зерен и сопровождается снижением механической прочности металла; Ø Коррозия под напряжением – разрушение металлов при одновременном действии среды и растягивающих нагрузок (под действием сжимающих нагрузок не наблюдается); Ø Фреттинг – коррозия (охватывание в условиях микроперемещения) возникает при постоянном или периодическом трении двух контактирующих металлических поверхностей; Ø Осленная коррозия характеризуется образованием на металлической поверхности коррозионных язвин наблюдается в специфических условиях работы; Ø Основная причина возникновения коррозии – разность потенциалов в стальных конструкциях. Основная причина возникновения разности потенциалов – наличие на поверхности металла различным допуском кислорода (а). Коррозия начинается в центре капли воды (доступ кислорода ограничен). Катодные участки на периферии наплыва, где доступ O2 к поверхности облегчен. Неоднократность состава электролита – (б) участки обшивки планера, на которых накапливаются комки грязи с различным содержанием воды и солей. Щелевая коррозия – повышенное содержание кислорода в электролите, на поверхности и пониженное в электролите, накапливающимся в вершине щели (в). Реже возникает щелевая коррозия в хорошо загерметизированных соединениях (г). Электролит может просачиваться в соединения благодаря неровностям, имеющимся на двух контактирующих металлических поверхностях. Перепады температуры, неравномерная освещенность и даже перемешивание электролита могут переводить к разности потенциалов, достаточной для начала процессов ржавления (д). Одной из причин ржавления стали может являться неоднородность её структуры (ё). Зерна в стали из различных кристаллических образованиях, между ними может возникнуть разность потенциалов. Высокие локальные нагрузки вызывают резкое изменение электрического потенциала (ж). Точка приложения механической нагрузки является анодом коррозийного гальванического элемента. Аналогично действию внешних нагрузок на процесс коррозии оказывают локальные остаточные напряжения (з), которые возникают в остальных штампованных или гнутых конструкциях.
Поиск по сайту: |
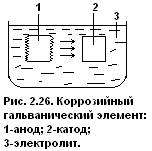 Освобождающие при этом электроны переходят анодных участков к катодным, т.е. возникает коррозийный ток. В реальных условиях обычно коррозийные гальванические элементы располагаются в различных точках в оной и той же металлической детали. Рис. это может возникнуть из-за неоднородности состава
Освобождающие при этом электроны переходят анодных участков к катодным, т.е. возникает коррозийный ток. В реальных условиях обычно коррозийные гальванические элементы располагаются в различных точках в оной и той же металлической детали. Рис. это может возникнуть из-за неоднородности состава
 значения электронного потенциала и физических свойств пленки на поверхности металла.
значения электронного потенциала и физических свойств пленки на поверхности металла. Щелевая коррозия – ржавление по стыку в местах расположения щели.
Щелевая коррозия – ржавление по стыку в местах расположения щели.