 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ УДЕЛЬНЫХ ТЕПЛОЕМКОСТЕЙ ГАЗОВ МЕТОДОМ КЛЕМАНА-ДЕЗОРМА
Приборы и принадлежности: стеклянный баллон с трехходовым краном, манометр, воздушный насос. Краткая теория Опыт показывает, что количество теплоты
где с - удельная теплоемкость вещества. Из формулы (1) следует
Отсюда видно, что удельной теплоемкостью называется количество теплоты, необходимое для нагревания вещества массой 1 кг на 1 К. Положив m=1 кг, Кроме удельной теплоемкости вещества вводится понятие молярной теплоемкости С. Молярной теплоемкостью называется количество теплоты, необходимое для нагревания моля вещества на 1 К. Из определения удельной теплоемкости следует, что она связана с молярной соотношением
где μ- молярная масса вещества. Единицей С является Дж/(моль×К). Состояние газа может быть охарактеризовано тремя величинами - параметрами состояния: давлением p, объемом V и температурой T. Уравнение, связывающее эти величины, называется уравнением состояния вещества. Для случая идеального газа уравнением состояния является уравнение Менделеева-Клапейрона, которое для одного моля газа будет иметь вид pV = RT (4) где R - универсальная газовая постоянная. Величина теплоемкости газов зависит от условий нагревания. Выясним эту зависимость, воспользовавшись уравнением состояния (4) и первым началом термодинамики, которое можно сформулировать следующим образом: количество теплоты По определению теплоемкости Из уравнения (6) видно, что теплоемкость может иметь различные значения в зависимости от способов нагревания газа, так как одному и тому же значению Внутренняя энергия 1 моля газа где i- число степеней свободы. Числом степеней свободы газа называется число независимых координат, определяющих положение тела в пространстве. При движении точки по прямой линии для оценки ее положения надо знать одну координату, т.е. точка имеет одну степень свободы. Если точка движется по плоскости, ее положение характеризуется двумя координатами, т.е. точка обладает двумя степенями свободы. Положение материальной точки в пространстве определяется тремя координатами.
Рассмотрим основные процессы, протекающие в идеальном газе при изменении температуры, когда масса газа остается неизменной и равна одному молю. Количество теплоты, необходимое для нагревания одного моля газа на 1К, определяется молярной теплоемкостью. Изохорический процесс. Процесс называется изохорическим, если объем тела при изменении температуры остается постоянным, т.е. V=const. В этом случае: Изобарический процесс. Процесс, протекающий при постоянном давлении (P=const), называется изобарическим. Для этого случая формула (6) перепишется в виде: Из уравнения газового состояния (4) получаем:
Но Р=const и dР=0. Следовательно, Сравнив (8) и (11), получим Изотермический процесс. Изотермическим процессом называется процесс, протекающий при постоянной температуре (T=const). В этом случае Адиабатический процесс. Процесс, протекающий без теплообмена с окружающей средой, называется адиабатическим. Первое начало термодинамики для такого процесса будет иметь вид т.е. при адиабатическом процессе расширения или сжатия, работа совершается газом только за счет изменения запаса внутренней энергии. Выведем уравнение адиабатического процесса. При адиабатическом расширении работа совершается за счет убыли внутренней энергии
Но Разделив уравнение (10) на (12) и учитывая (12), получим
где Интегрируя и потенцируя, получим уравнение Пуассона:
Используя формулы (11) и (12), для γ можно получить:
Эта формула справедлива как для молярных, так и для удельных теплоемкостей газов. Таким образом, по значениям теплоемкостей все газы можно разделить на три сорта: одноатомные, двухатомные, многоатомные газы.
Поиск по сайту: |
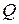 , необходимое для нагревания массы однородного вещества от температуры Т1 до Т2 градусов, пропорционально массе вещества и изменению температуры:
, необходимое для нагревания массы однородного вещества от температуры Т1 до Т2 градусов, пропорционально массе вещества и изменению температуры: (2)
(2) , получим единицу удельной теплоемкости:
, получим единицу удельной теплоемкости: 
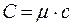 , (3)
, (3)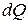 , переданное системе, затрачивается на увеличение ее внутренней энергии
, переданное системе, затрачивается на увеличение ее внутренней энергии 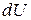 и на работу
и на работу 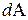 , совершаемую системой против внешних сил
, совершаемую системой против внешних сил 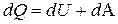 . (5)
. (5)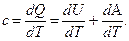 (6)
(6)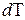 могут соответствовать различные значения
могут соответствовать различные значения 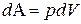 .
. , (7),
, (7), Число степеней свободы молекулы обычно обозначается буквой i-. Молекулы, которые состоят из одного атома, считаются материальными точками и имеют число степеней свободы i- =3. Такими являются молекулы аргона, гелия и др. Двухатомные молекулы (H2, N2 и др.) обладают числом степеней свободы i=5; они имеют три степени свободы поступательного движения вдоль осей X, Y, Z и две степени свободы вращения вокруг осей X и Z (рис.1, а). Вращением вокруг оси Y можно пренебречь, т.к. момент инерции ее относительно этой оси очень мал. Молекулы, состоящие из трех и более жестко связанных атомов, не лежащих на одной прямой (рис.1, б), имеют число степеней свободы i = 6: три степени свободы поступательного движения и три степени свободы вращения вокруг осей X, Y, Z. Столько же степеней свободы имеют и другие многоатомные молекулы.
Число степеней свободы молекулы обычно обозначается буквой i-. Молекулы, которые состоят из одного атома, считаются материальными точками и имеют число степеней свободы i- =3. Такими являются молекулы аргона, гелия и др. Двухатомные молекулы (H2, N2 и др.) обладают числом степеней свободы i=5; они имеют три степени свободы поступательного движения вдоль осей X, Y, Z и две степени свободы вращения вокруг осей X и Z (рис.1, а). Вращением вокруг оси Y можно пренебречь, т.к. момент инерции ее относительно этой оси очень мал. Молекулы, состоящие из трех и более жестко связанных атомов, не лежащих на одной прямой (рис.1, б), имеют число степеней свободы i = 6: три степени свободы поступательного движения и три степени свободы вращения вокруг осей X, Y, Z. Столько же степеней свободы имеют и другие многоатомные молекулы. . Следовательно, и
. Следовательно, и  , т.е. при этом вся подводимая к газу теплота идет на увеличение его внутренней энергии. Тогда из уравнения (6) следует, что молярная теплоемкость газа при постоянном объеме равна
, т.е. при этом вся подводимая к газу теплота идет на увеличение его внутренней энергии. Тогда из уравнения (6) следует, что молярная теплоемкость газа при постоянном объеме равна 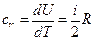 . (8)
. (8) . (9)
. (9) . (10)
. (10)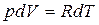 . Подставляя это выражение в уравнение (9), получим
. Подставляя это выражение в уравнение (9), получим 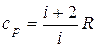 . (11)
. (11) . (12)
. (12)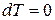 и
и  , т.е. внутренняя энергия газа остается постоянной и все подводимое тепло расходуется на работу.
, т.е. внутренняя энергия газа остается постоянной и все подводимое тепло расходуется на работу. :
: 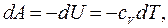
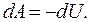
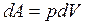 и
и 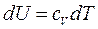 , значит,
, значит, 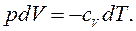

 называется отношением удельных теплоемкостей
называется отношением удельных теплоемкостей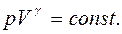 (13)
(13)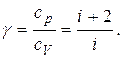 (14)
(14)