 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Окислительно-восстановительная двойственность
Если степень окисления некоторого атома в химическом соединении промежуточная, то этот атом может как принимать электроны (т.е. быть окислителем), так и отдавать их (т.е. быть восстановителем). Такое поведение, в частности, характерно для пероксида водорода, поскольку в состав молекулы Н2O2 входят атомы кислорода в промежуточной степени окисления минус 1:
При прогнозировании поведения пероксида водорода и других веществ, характеризующихся окислительно-восстановительной двойственностью, необходимо учитывать следующее. Если, например, для пероксида водорода партнёром по реакции является вещество, способное быть только окислителем (KMnO4, K2Cr2O7), то H2O2 будет вести себя как восстановитель и окисляться до O2. Если же пероксид водорода взаимодействует с веществом, способным проявлять только восстановительные свойства (KI), то молекулы H2O2 будут выполнять функцию окислителя, восстанавливаясь до молекул H2O. Окислительно-восстановительная двойственность характерна также для азотистой кислоты и нитритов:
Активные неметаллы, например, галогены в щелочных растворах подвергаются реакциям самоокисления-самовосстановления (диспропорционирования); в этих реакциях одна часть атомов простого вещества является окислителем, а другая – восстановителем: Cl20 ® 2Cl–1 Cl20 ® 2Cl–1 Cl20 ® 2 Несмотря на то, что вещества, в состав которых входит атом в промежуточной степени окисления, теоретически могут быть как окислителями, так и восстановителями, на практике часто преимущественно проявляются либо окислительные, либо восстановительные свойства. Например, атомы Mn+4, Cu+2, Fe+2, S+4 в соединениях MnO2, CuSO4, Fe(OH)2, Na2SO3, в принципе, могут проявлять как окислительные, так и восстановительные свойства, однако оксид марганца (IV) в кислых растворах – сильный окислитель, восстанавливающийся в соответствии со схемой: MnO2 ® Mn2+;
соединения двухвалентной меди проявляют окислительные свойства, восстанавливаясь до соединений одновалентной меди:
Cu2+ ® Cu+1; соединения железа (II) легко окисляются до соединений железа (III):
Fe2+ ® Fe3+; Fe(OH)2 ® Fe(OH)3;
растворимые соли железа (III) проявляют окислительные свойства, восстанавливаясь до соединений железа (II): Fe3+ ® Fe2+;
сульфиты – сильные восстановители и легко окисляются до сульфатов:
SO32– ® SO42–.
Некоторые неметаллы (C, S, P, As) окисляются концентрированной азотной кислотой до высшей степени окисления:
С ® CO2; S ® SO42– P ® H3PO4 As ® H3AsO4
Йод окисляется азотной кислотой до степени окисления +5: I2 ® HIO3. Сама HNO3 в этих реакциях может восстанавливаться как до NO2, так и до NO.
Неметаллы могут также окисляться концентрированной серной кислотой:
С ® CO2; S ® SO2 H2 ® H2O P ® H3PO4
При этом H2SO4 восстанавливается до SO2.
Далее рассматриваются примеры, иллюстрирующие использование приведённого выше теоретического материала при прогнозировании продуктов окислительно-восстановительных реакций.
Пример 4.1Спрогнозируйте продукты следующей окислительно-восста-новительной реакции и составьте уравнение реакции ионно-электронным методом (т.е. методом полуреакций): K2Cr2O7 + N2H4 + H2SO4 ® … . При выполнении данного задания следует учитывать, что запись H2SO4 в условии подразумевает разбавленную серную кислоту; если в реакции участвует концентрированная серная кислота – будет применяться запись H2SO4 (конц.). Разбавленная серная кислота в подавляющем большинстве окислительно-восстановительных реакций (исключение – реакции с активными металлами) не проявляет себя ни как окислитель, ни как восстановитель и применяется для создания кислой среды. Следовательно, окислитель и восстановитель нужно искать среди двух оставшихся веществ. Атом хрома в K2Cr2O7 находится в высшей степени окисления +6. Поэтому в любой окислительно-восстановительной реакции K2Cr2O7 ведёт себя как окислитель. В кислой среде дихромат-ионы восстанавливаются до ионов Cr3+: Cr2O72– ® 2Cr3+. В молекуле N2H4 атом азота находится в промежуточной степени окисления минус 2. Теоретически атом в промежуточной степени окисления может быть как окислителем, так и восстановителем. Но в данной реакции функцию окислителя выполняет K2Cr2O7. Поэтому гидразин (N2H4) – восстановитель. Как уже было ранее сказано, атомы-восстановители в отрицательной степени окисления обычно окисляются до нулевой степени окисления. Поэтому, даже не зная химии гидразина, можно предположить, что продуктом его окисления в данной реакции будет азот: N2H4 ® N2.
Исходные схемы превращений: Cr2O72– ® 2Cr3+ N2H4 ® N2 Процедура составления ионно-электронных уравнений подробно рассмотрена в методических указаниях по общей химии [2]. Напомним кратко важнейшие правила уравнивания атомов кислорода и водорода при составлении полуреакций.
В ту часть составляемого ионно-электронного уравнения реакции, протекающей в кислой среде, где имеется недостаток атомов кислорода, следует записать на каждый недостающий атом О одну молекулу Н2О, а в другую часть уравнения – два иона Н+. В ту часть составляемого ионно-электронного уравнения реакции, протекающей в кислой среде, где не хватает атомов водорода следует записать нужное количество ионов Н+.
N2H4 ® N2 + 4H+ + 4e– 3
2Cr2O72– + 3N2H4 + 28H+ ® 4Cr3+ + 3N2 + 12H+ + 14H2O 2Cr2O72– + 3N2H4 + 16H+ ® 4Cr3+ + 3N2 + 14H2O 2K2Cr2O7 + 3N2H4 + 8H2SO4 ® 3N2 + 2Cr2(SO4)3 + 2K2SO4 + 14H2O Пример 4.2 Спрогнозируйте продукты следующей окислительно-восстановительной реакции и составьте уравнение реакции ионно-электронным методом (т.е. методом полуреакций): Cl2 + KOH ® … . Щёлочи (LiOH, NaOH, KOH, Ca(OH)2, Ba(OH)2) в водных растворах не проявляют ни окислительных, ни восстановительных свойств. При проведении окислительно-восстановительных реакций эти вещества используются для создания щелочной среды. Следовательно, и окислителем, и восстановителем в данной реакции являются атомы хлора; это реакция самоокисления-самовосстановления (реакция диспропорционирования). Атомы хлора (нулевая степень окисления), являющиеся окислителем, принимают электроны; их степень окисления становится равной минус 1: Cl2 ® 2Cl–. Другая часть атомов хлора отдают электроны и приобретают положительную степень окисления; обычно, в реакциях диспропорционирования галогенов это или степень окисления +1 (например, HClO, KClO) или +5 (например, HClO3, KClO3). Очевидно, что в щелочной среде продуктом реакции не может быть кислота. Следовательно, при окислении хлора в щелочной среде может получиться соль (KClO или KClO3). Рассмотрим, например превращение Cl2 ® 2ClO3–. Исходные схемы превращений: Cl2 ® 2Cl– Cl2 ® 2ClO3–
В ту часть составляемого ионно-электронного уравнения реакции, протекающей в щелочной среде, где недостаёт атомов кислорода, следует записать на каждый недостающий атом кислорода два иона OH–, а в другую часть уравнения – одну молекулу H2O.
Cl2 + 12OH– ® 2ClO3– + 6H2O + 10e– 1
6Cl2 + 12OH– ® 10Cl– + 2ClO3– + 6H2O 3Cl2 + 6OH– ® 5Cl– + ClO3– + 3H2O 3Cl2 + 6KOH ® 5KCl + KClO3 + 3H2O Пример 4.3. Спрогнозируйте продукты следующей окислительно-восста-новительной реакции и составьте уравнение реакции ионно-электронным методом (т.е. методом полуреакций): KMnO4 + H2O2 + KOH ® … .
Атом марганца в KMnO4 находится в высшей степени окисления +7. Поэтому в любой окислительно-восстановительной реакции KMnO4 проявляет свойства окислителя. В щелочной среде атом Mn+7 в составе перманганат-иона восстанавливается до Mn+6 (образуется манганат-ион): MnO4– ® MnO42–. KOH обеспечивает щелочную среду и не проявляет окислительно-восстановительную активность (см. пример 4.2). Следовательно, восстановителем являются атомы кислорода в молекуле H2O2, степень окисления которых равна минус 1 (промежуточная). Атомы кислорода O–1 окисляются до нулевой степени окисления (типичное поведение восстановителя в отрицательной степени окисления): H2O2 ® O2.
Исходные схемы превращений: MnO4– ® MnO42– H2O2 ® O2 Составление полуреакции превращения H2O2 ® O2 требует уравнивания атомов водорода: если в какой-либо части составляемого ионно-электронного уравнения реакции, протекающей в щелочной среде, имеется избыток атомов водорода, то в эту часть уравнения на каждый избыточный атом водорода следует записать один ион OH–, а в другую часть уравнения – одну молекулу Н2О.
H2O2 + 2OH– ® O2 + 2H2O + 2e– 1
2MnO4– + H2O2 + 2OH– ® 2MnO42– + O2 + 2H2O 2KMnO4 + H2O2 + 2KOH ® 2K2MnO4 + O2 + H2O Пример 4.4. Спрогнозируйте продукты следующей окислительно-восста-новительной реакции и составьте уравнение реакции ионно-электронным методом (т.е. методом полуреакций): KMnO4 + NaNO2 + H2O ® … . Атом марганца в KMnO4 находится в высшей степени окисления +7 (окислитель). В нейтральной среде (в левой части уравнения – молекулы воды) KMnO4 (Mn+7) восстанавливается до MnO2 (Mn+4): MnO4– ® MnO2¯. Атом азота в NaNO2 находится в промежуточной степени окисления +3 и поэтому нитрит натрия выступает в качестве восстановителя, окисляясь до нитрата: NO2– ® NO3–. Исходные схемы превращений: MnO4– ® MnO2¯ NO2– ® NO3–
Следует иметь в виду, что в ходе реакции, которая начинается в нейтральной среде, может происходить либо подкисление раствора, либо подщелачивание, либо среда раствора останется без изменений. Таким образом, в рассматриваемом примере при составлении полуреакций нужно определиться, как уравнивать атомы кислорода: с помощью ионов H+ и молекул H2O (кислая среда) или же с помощью ионов OH– и молекул H2O (щелочная среда).
MnO4– + 4H+ + 3e– ® MnO2¯ + 4H2O 2 NO2– + H2O ® NO3– + 2H+ + 2e– 3
2MnO4– + 3NO2– + 8H+ + 3H2O ® 2MnO2¯ + 3NO3– + 6H+ + 4H2O 2MnO4– + 3NO2– + 2H+ ® 2MnO2¯ + 3 NO3– + H2O
Этот результат противоречит условию: в левой части ионно-молекулярного уравнения оказались ионы Н+, хотя по условию реакция должна начинаться в нейтральной среде. Следовательно, уравнивание атомов кислорода лучше выполнить с помощью ионов OH– и молекул H2O.
NO2– + 2OH– ® NO3– + H2O + 2e– 3
2MnO4– + 3NO2– + 6OH– + 4H2O ® 2MnO2¯ + 3NO3– + 8OH– + 3H2O 2MnO4– + 3NO2– + H2O ® 2MnO2¯ + 3NO3– + 2OH– 2KMnO4 + 3NaNO2 + H2O ® 2MnO2¯ + 3NaNO3 + 2KOH
Варианты заданий по теме прогнозирование продуктов окислительно-восстановительных реакций представлены в таблице 4.1
Задание № 4 Спрогнозируйте продукты окислительно-восстановительных реакций (таблица 4.1) и составьте уравнения этих реакций ионно-электронным методом (т.е. методом полуреакций).
Таблица 4.1 – Условия задания № 4
Продолжение таблицы 4.1
Поиск по сайту: |
 (окислитель) ® Н2O–2 (2O–1 + 2e– ® 2O–2)
(окислитель) ® Н2O–2 (2O–1 + 2e– ® 2O–2)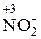 (окислитель) ®
(окислитель) ® 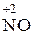 , или
, или 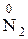 , или
, или 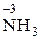 ;
;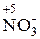 .
.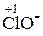 Cl20 ® 2
Cl20 ® 2 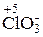
 Cr2O72– + 14H+ + 6e– ® 2Cr3+ + 7H2O 2
Cr2O72– + 14H+ + 6e– ® 2Cr3+ + 7H2O 2
 Cl2 + 2e– ® 2Cl– 5
Cl2 + 2e– ® 2Cl– 5

 Если предпринять попытку уравнять атомы кислорода по правилу для кислой среды, то получится следующий результат:
Если предпринять попытку уравнять атомы кислорода по правилу для кислой среды, то получится следующий результат: MnO4– + 2H2O + 3e– ® MnO2¯ + 4OH– 2
MnO4– + 2H2O + 3e– ® MnO2¯ + 4OH– 2