 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Элементы III периода (Na–Ar)
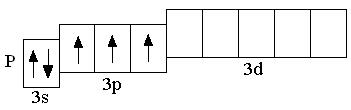
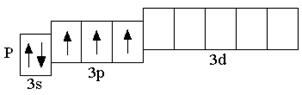
Электронная конфигурация внешнего энергетического уровня атомов элементов III периода аналогична электронной конфигурации атомов элементов II периода. Различие состоит лишь в том, что у элементов III периода заполняются орбитали третьего энергетического уровня (n = 3), который образован одной s-орбиталью, тремя p-орбиталями, пятью d-орбиталями:
элемент второго периода элемент третьего периода
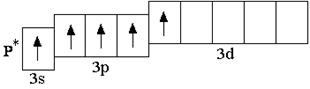
У атомов всех элементов III периода, находящихся в невозбуждённом состоянии, 3d-орбитали являются вакантными (т.е. незаполненными электронами). Невозбуждённое (основное) состояние атома – это такое состояние, в котором каждый электрон занимает орбиталь с минимально возможной энергией. В возбуждённом состоянии электрон занимает орбиталь с более высокой энергией, хотя мог бы находиться на орбитали с более низкой энергией:
невозбуждённое состояние возбуждённое состояние
Анализируя число неспаренных электронов в атоме, можно спрогнозировать его валентность: атом фосфора может быть как трёхвалентным (3 неспаренных электрона в основном состоянии), так и пятивалентным (в возбуждённом состоянии). Теоретически, на 9 атомных орбиталях третьего энергетического уровня могли бы разместиться 18 электронов. Но на практике на внешнем энергетическом уровне любого атома не бывает более 8 электронов. Таким образом, все восьмиэлектронные конфигурации ns2np6 являются завершёнными. Несмотря на то, что у атома аргона есть свободные 3d-орбитали, их заполнение происходит только в следующем четвёртом периоде.
У последнего элемента III периода – аргона – полностью заполнены 3s- и 3p-подуровни, но свободны все 3d-орбитали. Однако, у следующих за аргоном элементов – калия и кальция – заполнение третьего электронного слоя временно прекращается и начинает формироваться s-подуровень внешнего четвёртого энергетического уровня:
K 1s22s22p63s23p63d04s1 Ca 1s22s22p63s23p63d04s2 Это объясняется тем, что
Sc 3d14s2
V 3d34s2
У последнего (десятого) d-элемента IV периода – цинка – 10 d-электронов:
Zn 3d104s2
Следует обратить внимание, что электронная конфигурация атома хрома (четвёртый по счёту d-элемент IV периода) не 3d44s2, а 3d54s1.
Поиск по сайту: |

 1.6 Элементы IV периода (K–Kr)
1.6 Элементы IV периода (K–Kr)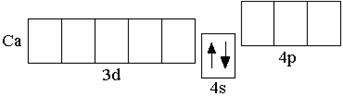 После кальция появляется ряд из десяти d-элементов (Sc–Zn), у которых происходит заполнение 3d-орбиталей. Например, у первого d-элемента IV периода скандия на d-орбиталях находится один электрон,
После кальция появляется ряд из десяти d-элементов (Sc–Zn), у которых происходит заполнение 3d-орбиталей. Например, у первого d-элемента IV периода скандия на d-орбиталях находится один электрон,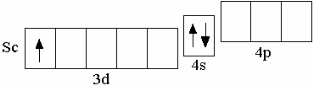
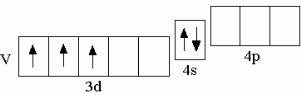 у третьего по счёту d-элемента IV периода – ванадия – на d-орбиталях располагаются 3 электрона,
у третьего по счёту d-элемента IV периода – ванадия – на d-орбиталях располагаются 3 электрона,
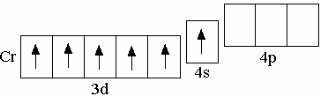 Это объясняется «проскоком» одного электрона с 4s-орбитали на 3d-орбиталь, в результате чего образуется наполовину заполненный 3d-подуровень, обладающий повышенной устойчивостью. Повышенной устойчивостью обладают также полностью заполненные электронами подуровни, вследствие чего «проскок» электрона происходит также у атома меди (медь – девятый d-элемент IV периода, однако его электронная конфигурация не 3d94s2, а 3d104s1). После ряда d-элементов в IV периоде идёт заполнение p-орбиталей у элементов Ga – Kr, электронная конфигурация которых аналогична электронной конфигурации p-элементов B – Ne или Al – Ar.
Это объясняется «проскоком» одного электрона с 4s-орбитали на 3d-орбиталь, в результате чего образуется наполовину заполненный 3d-подуровень, обладающий повышенной устойчивостью. Повышенной устойчивостью обладают также полностью заполненные электронами подуровни, вследствие чего «проскок» электрона происходит также у атома меди (медь – девятый d-элемент IV периода, однако его электронная конфигурация не 3d94s2, а 3d104s1). После ряда d-элементов в IV периоде идёт заполнение p-орбиталей у элементов Ga – Kr, электронная конфигурация которых аналогична электронной конфигурации p-элементов B – Ne или Al – Ar.