 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Синдром раздраженного кишечника 1 страница
Синдром раздраженного кишечника (СРК) — устойчивая совокупность функциональных расстройств, проявляющаяся болью и/или чувством дискомфорта в животе, которые проходят после дефекации, и сопровождающаяся изменением частоты и консистенции стула. Эти расстройства должны продолжаться не менее 12 нед на протяжении последних 12 мес. Заболевание широко распространено, по данным мировой статистики, СРК страдают 15—20 % населения, женщины болеют в 2—4 раза чаще, чем мужчины. Наибольшая распространенность заболевания отмечается среди JjU 30—40 лет. Первое появление симптомов заболевания в пожилом возрасте считается маловероятным, поэтому диагноз СРК в подобных случаях сомнителен. Этиология и патогенез.Имеет значение наследственная предрасположенность (симптомы СРК у однояйцевых близнецов встречаются чаще, чем у двуяйцевых). Большое внимание уделяется психоэмоциональному стрессу (в анамнезе таких больных часто отмечаются так называемые жизненные стрессовые ситуации, а также состояние тревоги или же эпизоды депрессии). В патогенезе важное место отводится различным нарушениям двигательной функции кишечника. Эти нарушения, хотя и не являются специфичными для СРК и встречаются при других заболеваниях кишечника, все же считаются основной причиной возникновения болей и нарушений стула. У больных с СРК отмечается снижение порога чувствительности прямой кишки (висцеральная гипералгезия), которая проявляется снижением порога восприятия боли, а также более интенсивным ощущением боли при нормальном ее восприятии. У части больных с СРК выявляют изменения толстого кишечника в виде уменьшения его емкости («короткий» кишечник) либо дополнительную петлю в области сигмы («увеличение емкости»). Классификация.Согласно рекомендациям Международных рабочих совещаний (Рим, 1988, 1998), выделяют три формы заболевания: с преобладанием болей и метеоризма, с преобладанием диареи, с преобладанием запоров. Для СРК характерны следующие симптомы: 1) частота стула менее 3 раз в неделю; 2) частота стула более 3 раз в день; 3) твердый или комковатый стул; 4) жидкий (кашицеобразный) стул; 5) напряжение при акте дефекации; 6) неотложные (императивные) позывы на стул; 7) ощущение неполного опорожнения кишечника; 8) выделение слизи при дефекации; 9) вздутие живота. Для варианта СРК с преобладанием диареи характерно сочетание признаков 2, 4, 6 и отсутствие признаков 1, 3, 5. Для варианта СРК с преобладанием запоров характерно сочетание признаков 1, 3, 5 в отсутствие признаков 2, 4, 6. Клиническая картина.На Iэтапе диагностического поиска опрос больного позволяет с большой вероятностью предположить у пациента наличие СРК. Боли локализуются обычно в подвздошной области, они могут быть ноющими, тупыми или схваткообразными, не иррадиируют, усиливаются после приема пищи и уменьшаются после отхождения газов или дефекации. Ночью боли, как правило, не возникают. У женщин боли могут усиливаться во время менструаций. При преобладании запоров боли могут быть постоянными и зависят от спастического сокращения сигмовидной кишки. Нарушение двигательной Функции толстой кишки обусловливает появление стула в виде «овечьего» кала или орешков. Для нормализации функции кишечника больные часто прибегают к приему слабительных средств или применению очистительных клизм.
Достаточно часто встречаются внекишечные симптомы: наклонность к сердцебиениям и частым головным болям типа мигрени, общая повышенная возбудимость, неудовлетворенность дыханием (гипервентиляционный синдром). Кишечные нарушения часто сочетаются с синдромом раздраженного мочевого пузыря (до 30 %), неязвенной диспепсии (изменение аппетита, отрыжка, изжога), сексуальными нарушениями. На II этапе диагностического поиска выявляется немного значимых для диагноза признаков. Тем не менее можно обнаружить непостоянную болезненность по ходу спазмированного толстого кишечника, «шум плеска» и урчание в области слепой кишки. Отмечаются симптомы вегетативной дисфункции: холодные кисти и стопы, повышенное потоотделение, выраженный дермографизм, наклонность к тахи- или брадикардии; часто выявляется гипотония. Данные IIIэтапа диагностического поиска нужны прежде всего для исключения других заболеваний желудочно-кишечного тракта, так как диагноз СРК является «диагнозом исключения». Этому помогают исследования кала, эндоскопия и рентгенологическое исследование. Анализ кала предусматривает микроскопию, химическое исследование (определение в суточном кале аммиака и органических кислот), бактериологическое исследование. На основании этих исследований выделяют типичные копрологические синдромы при СРК. ♦ Синдром бродильной диспепсии: а) кашицеобразный кал кислой реакции; б) незначительное количество мыл и жирных кислот; в) очень много крахмала, перевариваемой клетчатки и йодофильной г) содержание органических кислот в суточном количестве кала увели ♦ Синдром гнилостной диспепсии: а) кашицеобразный темно-коричневый кал щелочной реакции с гнило б) в кале содержание обычных ингредиентов не превышает норму; в) резко увеличено содержание аммиака в суточном количестве кала. оз — уменьшение количества бифидо- и лактобактерий, увеличение количества гемолитических и лактозонегативных эшерихий, патогенного стафилококка, протея, гемолитического стафилококка. Определение суточной потери жира позволяет исключить внешнесекре-торную недостаточность поджелудочной железы при хроническом панкреа- jjire. Для выявления скрытой лактозной недостаточности используют тест с нагрузкой лактозой. При эндоскопическом исследовании различных отделов толстого кишечника прежде всего исключают воспалительные заболевания (неспецифический язвенный колит, болезнь Крона), а также опухоли, полипы, дивертикулы. Слизистая оболочка толстого кишечника обычно не изменена. При рентгенологическом исследовании обнаруживают типичные признаки дискинезии: неравномерное наполнение и опорожнение, чередование спастически сокращенных и дилатированных участков кишечника, избыточную секрецию в просвет кишечника. Данные ультразвукового исследования (по показаниям выполняют компьютерную томографию брюшной полости) позволяют исключить желчнокаменную болезнь, наличие кист и кальцинатов в поджелудочной железе, объемных образований в органах брюшной полости, способных обусловить симптомы кишечных расстройств. Биохимическое и клиническое исследование крови не обнаруживает каких-либо изменений. Диагностика.Распознавание болезни основано на выявлении типичных симптомов (указанных выше) и исключении «органических» поражений кишечника, а также других заболеваний желудочно-кишечного тракта, сопровождающихся кишечными расстройствами. Существенно, что клинические критерии, укладывающиеся в рамки «Римских критериев» СРК, не являются специфичными и могут встречаться при многих органических заболеваниях (опухоли кишечника, болезнь Крона, неспецифический язвенный колит, хронический панкреатит). В то же время можно отметить ряд признаков, при наличии которых диагноз СРК становится весьма вероятным. К ним относятся следующие: 1) длительное течение заболевания (как правило, многолетнее) без заметного прогрессирования; 2) многообразие имеющихся жалоб, обусловленных вегетативной дисфункцией; 3) изменчивый характер жалоб; 4) связь ухудшения самочувствия с психоэмоциональными факторами; 5) отсутствие болей и кишечных расстройств (диареи) в ночное время; 6) отсутствие так называемых симптомов тревоги — примеси крови в кале, лихорадки, необъяснимого похудения, анемии, увеличения СОЭ и др. Кишечная диспепсия наблюдается как изолированный признак при различных алиментарных перегрузках, чаще всего при перегрузке углеводами, реже — белковой пищей. В первом случае отмечается диарея, во втором — запоры. Если нет пищевых нарушений, то жалоб может и не быть. Причины диареи — размножение йодофильной флоры, что возможно и на фоне обычного питания. При эндоскопии изменений слизистой оболочки не наблюдается. При исследовании кала обнаруживают типичные копрологические синдромы бродильной или гнилостной диспепсии без признаков воспаления или повышенного выделения ферментов. Рентгенологически выявляют признаки дискинезии толстого кишечника. Общее состояние пациента не меняется. Нормализация питания быстро приводит к улучшению состояния. Опухоли кишечника следует исключить при первом обращении больного к врачу. При локализации опухоли в правой половине толстого кишечника в клинической картине доминирует железодефицитная анемия, а «кишечные» симптомы выражены мало. В связи с этим всем больным среднего и пожилого возраста с железодефицитной анемией следует проводить коло-Носкопию. Локализация опухоли в левой половине толстого кишечника обусловливает упорные запоры (иногда прерываемые эпизодами диареи). Слабительные средства, а также клизмы сначала способствуют опорожне- нию кишечника, а в дальнейшем становятся малоэффективными. Эти сим-птомы должны привлечь внимание врача (диагноз устанавливают после эндоскопического исследования). Хронический энтерит, неспецифический язвенный колит и болезнь Крона (см. соответствующие отделы данной главы). Следует еше раз напомнить, что диагноз СРК ставят после исключения целого ряда заболеваний и состояний, сопровождающихся нарушением деятельности кишечника. Лечение.Лечение больного СРК должно быть комплексным и включать: 1) общие мероприятия («образование больного» для правильного понимания существа имеющихся у него симптомов); 2) диетические мероприятия; 3) лекарственную терапию (в зависимости от преобладания диареи или запоров). Необходимо объяснить больному доброкачественность его страдания, демонстрируя ему данные лабораторных и инструментальных исследований, свидетельствующих об отсутствии у него тяжелых заболеваний (прежде всего опухолей кишечника и других отделов желудочно-кишечного тракта). Диетические мероприятия в настоящее время подверглись существенному пересмотру, тем не менее следует подробно расспросить больного о переносимости тех или иных продуктов с тем, чтобы дать определенные рекомендации (при диарее исключаются легко бродящие углеводы, грубая клетчатка; напротив, при запорах оправданы пищевые добавки — пшеничные отруби, семя льна). При СРК с преобладанием диареи назначают: а) регуляторы моторики — лоперамид в дозе по 0,002 г 2 таблетки 1 раз в день под язык до стабилизации стула (1—3 дня и более); б) смекту — 1 пакетик 3 раза в день до еды до оформления стула; в) один из пробиотиков — бифиформ по 1—2 капсулы 2 раза в день (2 нед), линекс 1—2 капсулы 3 раза в день (4 нед), лактобактерин 5 доз 2 раза в день (4 нед); г) пребиотик — хилак-форте по 60 капель 3 раза в день (4 нед). При СРК с преобладанием запоров назначают: а) мукофальк по 1—2 чайные ложки на ночь (2 нед) или макрогель-4000 по 10—20 г (1—2 пакетика) на ночь; б) лактулозу по 10—30 мл. При СРК с преобладанием болей применяют: а) спазмолитик миотроп-ного ряда — мебеверин по 0,2 г 2 раза в день; б) пинаверия бромид по 0,05 г 3 раза в день. Важным компонентом лечения больных СРК является применение психотропных средств, что обусловливается частой связью симптомов СРК с психотравмирующей ситуацией, повышенным уровнем тревоги и депрессии, которые обнаруживаются у 40—60 % пациентов. Чаще всего назначают (на 4—6 мес) тианептин (коаксил) по 1 таблетке 3 раза в день. Препарат весьма эффективен, хорошо переносится и не имеет побочных эффектов. Прогноз.СРК не имеет тенденции к прогрессированию, что делает его благоприятным, хотя полной ликвидации симптомов может и не быть. Хронический гепатит скийР£?ИЧЕСКИЙ. ГЕПАТИТ (ХГеп) - диффузный полиэтиологиче-Ewспалител™ процесс в печени, продолжающийся более 6 мес. н™5£°логически ХГеп характеризуется дистрофией или некрозами пече-I™ ™ Ю1СТОК (°Т единичных До массивных), инфильтрацией ткани печени иммунокомпетентными клетками и полиморфно-ядерными лейкоцита- jQi расширением портальных трактов за счет воспалительной инфильтрации в основном лимфоцитами и плазматическими клетками, фиброзом п0ртальных трактов при сохранении дольковой структуры печени. Хронический воспалительный процесс в печени может быть как самостоятельным в нозологическом отношении заболеванием, так и реакцией печеночной ткани на внепеченочные заболевания и очаговые поражения печени, т.е. являться неспецифическим реактивным гепатитом (НРГеп). К группе НРГеп примыкает хронический гранулематозный гепатит. Морфологические изменения печени при НРГеп не имеют тенденции к прогрессированию, течение НРГеп целиком зависит от динамики основного заболевания. Классификация.В основе применявшихся до настоящего времени классификаций ХГеп лежало разделение гепатита по морфологическому признаку с одновременной прогностической оценкой, т.е. определением тенденции прогрессирования в цирроз печени [Акапулько, 1974]. Все ХГеп подразделялись на хронический персистирующий гепатит (ХГТГеп), хронический активный гепатит (ХАГеп) и хронический лобуляр-ный гепатит (ХЛГеп). При ХПгеп гистологическое исследование биоптатов позволяло выявить расширение и умеренное склерозирование портальных полей без нарушения дольковой архитектоники, инфильтрацию портальных трактов, умеренную дистрофию гепатоцитов без некроза. Этот вариант ХГеп не трансформируется в цирроз печени. ХАГеп характеризуется обширными и сливающимися (мостовидными) некрозами, значительными дистрофическими изменениями гепатоцитов, выраженной инфильтрацией портальных трактов с распространением воспалительных инфильтратов в паренхиму, фиброзированием портальных трактов, проникающим в дольку. Этот вариант переходит в цирроз печени. ХЛГеп характеризуется мелкими некрозами и внутридольковой инфильтрацией. Изменения более выражены, чем при ХПГеп, но не достигают степени ХАГеп. Появление современной дифференцированной этиотропной терапии потребовало сделать акценты на этиологических аспектах. Классификацию, подразделяющую хронические гепатиты на ХПГеп, ХЛГеп, ХАГеп предлагается заменить новым подходом [Лос-Анжелес, 1994]. Хронический гепатит предлагается оценивать по следующим критериям: 1) по этиологии; 2) по клинической картине; 3) по гистологическим изменениям (т.е. по выраженности некрозов и воспаления); 4) по стадии хронизации (т.е. по распространенности фиброза). Этиология.Выделяют три основных этиологических типа ХГеп: 1) вирусный; 2) аутоиммунный; 3) лекарственный. Выделена и четвертая группа — криптогенный хронический гепатит, т.е. гепатит неуточненной этиологии. Авторы классификации исключили алкогольный, наследственный, токсический ХГеп, так как, по их мнению, не доказаны механизмы хрониза-Иии и прогрессирования этих гепатитов. Отечественные авторы к этиологическим факторам ХГеп относят и алкоголь, выделяя наряду с острым и хронический алкогольный гепатит, полагая, что алкогольный гепатит лежит в основе хронизации процесса. В группе вирусных гепатитов выделяют следующие этиологические Факторы: 1) вирус гепатита В — HBV; 2) вирус гепатита D — HDV; 3) ви-РУс гепатита С — HCV; 4) неопределенные (негепатотропные) или неизвестные вирусы. Основной массив в полиэтиологической группе ХГеп составляют гепатиты вирусной этиологии, среди них чаще всего встречается гепатит, вызванный вирусом В (HBV). Считают, что 5 % населения Земли страдают ХВГеп В, эта нозология занимает девятое место среди причин смерти. Такая распространенность обусловлена высокой заболеваемостью острым гепатитом В. У 3 % перенесших желтушную форму острого гепатита В болезнь переходит в хроническую форму, причем чаще у мужчин. Носителями HBV являются 300—370 млн человек, в Западной Европе носители составляют 0,2—1 %, в России — 7 %. В последние годы быстрыми темпами растет заболеваемость хроническим вирусным гепатитом С (ХВГеп С). При этом отмечают значительные географические различия: ХВГеп С имеют 0,4 % населения Европы и 15 % населения Центральной Африки. Возросло значение в генезе ХГеп алкоголя и метаболических болезней печени (болезнь Вильсона—Коновалова, гемохроматоз, неалкогольный стеатогепатит). Пути передачи HBV, HCV, HDV идентичны. Вирусы гепатита A (HAV) и гепатита Е (HEV) не являются причиной хронических гепатитов. Хронический аутоиммунный гепатит (ХАИТ) был описан в 1950 г. Вальденстремом и имеет много названий, отражающих различные особенности заболевания (ювенильный цирроз, гепатит молодых женщин, гипер-у-глобулинемический гепатит, люпоидный гепатит). Этиология этого гепатита неизвестна, но ясно, что ХАИТ — это заболевание, обусловленное нарушением регуляции иммунитета, дефектом су-прессорных Т-клеток и продукцией аутоантител к антигенам гепатоцитов. Список лекарств, вызывающих при определенных условиях поражение печени, весьма велик. Рассматривают два основных механизма повреждения печени: прямое и непрямое патологическое воздействие. На реакцию лекарственной гепатотоксичности влияют пол, возраст, ожирение, злоупотребление алкоголем, дефицит белка в пищевом рационе. К поражению предрасполагает прием одновременно нескольких лекарств (полипрогмазия), частые повторные курсы такого лечения. Алкоголь вызывает разнообразные повреждения печени: острый и хронический гепатит, жировую дистрофию печени, фиброз и цирроз печени. Характер поражения во многом зависит от дозы и длительности алкоголизации. Отечественные морфологи и клиницисты убедительно показали механизмы хронизации гепатита при хронической алкогольной интоксикации. Алкоголь и особенно его метаболит ацетальдегид оказывают гепатотокси-ческий эффект, разрушая клеточные мембраны гепатоцитов, повреждая микротрубочки цитоскелета и запуская процесс перекисного окисления липидов. Ацетальдегид также может образовывать комплексы с белками клеток печени (неоантигены) и нарушать репаративные процессы в ядре. Гистологическая оценка любого ХГеп основывается на определении выраженности некроза и воспаления. Наибольшее распространение получила градация с использованием индекса гистологической активности по Кноделю. Портальное воспаление оценивается от 0 до 4 баллов, внутрй-дольковая дегенерация и очаговые некрозы — 0—4 балла, перипортальные некрозы, мостовидные некрозы — от 0 до 10 баллов. Высокой активности соответствуют 13—18 баллов, минимальной — 1—3. Степени активности заменили ранее используемые понятия «ХАГеп», «ХПГеп», «ХЛГеп». При этом портальное воспаление и внутридольковая дегенерация соответствуют морфологии ХПГеп, очаговые некрозы — ХЛГеп, а перипортальные и мостовидные некрозы — морфологии ХАГеп. Патогенез.Возбудитель ХГеп HBV — крупный ДНК-содержащий вирус. На наружной его поверхности находится поверхностный антиген —' ugsAg, ядерными антигенами являются HBcAg и HBeAg. Ядро вируса содержит ДНК HBV (HBV-DNA) и ДНК-полимеразу (DNA-P). Все эти вирусные компоненты и антитела к его антигенам являются специфическими Маркерами данной инфекции. В своем развитии HBV проходит две фазы: фазу репликации и фазу интеграции. В фазе репликации геном вируса и клетки автономны (в эту фазу возможна полная элиминация вируса из организма). Повреждение гепатоцитов обусловлено не самим вирусом, а иммунокомпетентными клетками, распознающими его антигены. HBcAg и HBeAg обладают сильными имму-ногенными свойствами, a HBsAg — слабыми иммуногенными свойствами. В фазе репликации HBV, когда синтезируется HBcAg и HBeAg, сила иммунных реакций достаточно высока, в результате чего некротизируются гепатоииты. В фазе интеграции HBV происходит встраивание генома вируса в область клеточного генома (элиминация вируса в эту фазу невозможна). В большинстве случаев формируется состояние иммунологической толерантности к HBsAg, что приводит к купированию активности процесса (в ряде случаев может происходить регресс хронического гепатита вплоть до формирования «здорового» носительства HBsAg). ХВГепВ не всегда предшествует распознаваемая острая форма гепатита В. Хронизация зависит от продолжающейся репликации вируса и состояния иммунной системы больного. HBV не оказывает прямого повреждающего действия на гепатоцит, и лизис инфицированных гепатоцитов является следствием иммунного ответа больного. Нарушение гуморального и клеточного иммунитета определяет исход гепатита В. У пациентов с ХВГепВ наблюдается неполноценный клеточно-опосре-дованный иммунный ответ на вирусную инфекцию. В случае, если ответ слишком слабый, то иммунное поражение гепатоцитов или отсутствует, или весьма незначительное, но при этом продолжается репликация вируса на фоне нормально функционирующей печени. Как правило, это здоровые носители HBV. У больных с выраженным клеточно-опосредованным иммунным ответом происходит некроз гепатоцитов, но при этом ответ недостаточен для полной элиминации вируса и развивается ХВГепВ. Недостаточность ответа связана с цитотоксическими лимфоцитами, дефектом регуляции Т-супрессоров, наличием блокирующих антител на мембране гепатоцитов. Вирус гепатита С, как полагают, вызывает прямое цитотоксическое действие: существует корреляция между тяжестью заболевания и уровнем виремии. Иммунный ответ на HCV слабый. Длительное сохранение (персистирование) вируса в организме больного объясняется недостаточной иммунной реакцией в ответ на появление антигенов вируса в организме (вероятно, имеется недостаточная продукция противовирусных антител). Даже отсутствие антител к HCV в ряде случаев не исключает диагноз ХГеп, вызванного вирусом С. В целом антитела к HCV образуются медленно, что занимает в среднем 20 нед от момента инфицирования. У некоторых больных для образования антител требуется около года. Кроме того, вирус, повреждая мембрану гепатоцита, высвобождает мембранный липопротеид, входящий в структуру специфического печеночного антигена. Этот антиген, воздействуя на Т-лимфоциты, приводит к образованию «агрессивных» форм этих клеток. Однако эти клетки функционально Неполноценны, и «атака» ими гепатоцитов, ставших для организма чужерод-
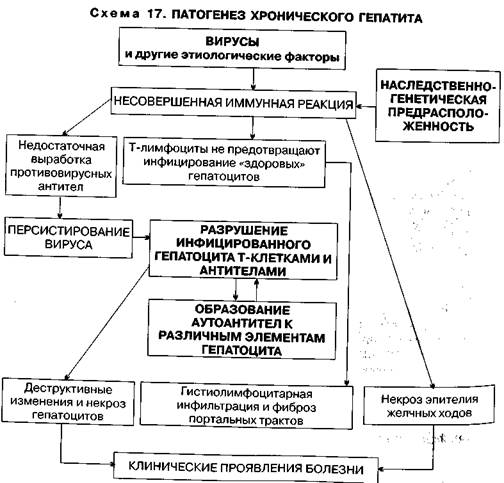
ными (вследствие воздействия на них вируса), хотя и приводит к гибели последних, но не обеспечивает полной элиминации вируса из организма. Под воздействием самых различных патогенных факторов гепатоццт приобретает новые антигенные детерминанты (становится аутоантиген-ным), что обусловливает ответную реакцию иммунной системы в виде продукции аутоантител. Имеющийся генетический дефект иммунной системы («слабость» Т-супрессоров) обусловливает неконтролируемую продукцию аутоантител, реакция антиген—антитело на поверхности гепатоцитов вызывает их гибель, формирующиеся иммунные комплексы (вначале циркулирующие, а затем фиксированные в микроциркуляторном русле) обусловливает наряду с поражением гепатоцитов вовлечение в патологический процесс других органов и систем. Гуморальные и клеточные иммунные реакции и поражение гепатоцитов обусловливают морфологические признаки ХГеп — гистиолимфоцитарную инфильтрацию портальных трактов, дистрофические и некротические изменения гепатоцитов и эпителия желчных ходов. Патогенез ХГеп представлен на схеме 17. Клиническая картина.Проявления ХГеп весьма разнообразны и зависят оТ этиологии, степени активности и хронизаиии, функционального состояния печени. Клиническая картина включает в себя следующие клинико-лаборатор- нЫе синдромы: • болевой, • цитолитический, • иммуновоспалительный, • холестатический, • астенический, • диспепсический. Боли при ХГеп возникают при увеличении объема печени и растяжении фиброзной капсулы; этот вариант болей не зависит от характера пищи и чаше всего ощущается больными как тяжесть в правом подреберье. Боли также могут возникать при развитии очагов некроза вблизи крупных сосудов, желчных протоков и фиброзной капсулы; они сопровождаются желтухой, повышением температуры тела и активности трансаминаз в сыворотке крови. Цитолитический синдром неотделим от синдрома печеночно-клеточной недостаточности и является следствием гибели (лизиса) гепатоцитов или их дистрофии, что сопровождается нарушением функции печеночных клеток, нарушением проницаемости клеточных мембран. В кровь поступают продукты гибели клеток, что клинически проявляется снижением ряда функций печени; клинические признаки — желтуха, повышение температуры, снижение массы тела. Снижение способности печени деградировать эстрогены и вазоактивные вещества приводит к повышению их концентрации в крови; появляются телеангиэктазии на коже груди и плечевого пояса, печеночные ладони — пятнистая эритема тенара и гипотенара ладоней, гинекомастия и женский тип оволосения у мужчин, происходит изменение ногтей («белые» ногти), появляется красный «лакированный печеночный» язык. Лабораторные признаки синдрома: повышение активности в крови индикаторных ферментов: аланиновой аминотрансферазы (АЛТ), аспараги-новой аминотрансферазы (ACT), лактатдегидрогеназы (ЛДГ) общей и «печеночных» фракций ЛДГ — ЛДГ-4 и ЛДГ-5. Повышается активность специфических печеночных ферментов: сорбитдегидрогеназы, альдолазы, фруктозо-1-фосфатальдолазы, а также содержание прямой и непрямой Фракции билирубина. Возрастает концентрация витамина В12 и железа. Снижение синтетической функции печени приводит к падению концентрации в сыворотке крови альбуминов, холестерина, фермента холинэсте-разы, протромбина, V и VIII факторов свертывания крови (геморрагии). Снижение превращения в печени токсичных продуктов (аммиака, фенолов и Др.) в нетоксичные сопровождается интоксикацией, появлением «печеночного» запаха. Печеночная недостаточность с умеренными лабораторными проявлениями определяется как «малая печеночная недостаточность». Иммуновоспалительный (мезенхималъно-воспалителъный) синдром клинически проявляется лихорадкой, артралгиями, васкулитами с локализацией в коже, легких, почках, кишечнике, лимфаденопатией, спленомегалией. Лабораторными проявлениями являются: а) повышение уровня у-глобули-н°в, а,-глобулинов, уровня иммуноглобулинов класса G, М, А, гиперпро-теинемией, появлением патологических результатов «осадочных» проб; ") обнаружение в крови антител к гладкомышечным клеткам, митохондриям, ДНК, появление LE-клеток; в) снижение титра комплемента.
Астенический синдром отражает степень снижения функции печени и интоксикации. Клинические проявления: слабость, утомляемость (от ограничения физической нагрузки до невозможности самообслуживания), снижение настроения, апатия, ипохондрия. Диспепсический синдром обусловлен снижением желчесинтетической функции печени, интоксикацией и проявляется кишечной диспепсией (бродильной, гнилостной) и дисмоторной желудочной диспепсией (тошнота, рвота, снижение аппетита, анорексия).
Поиск по сайту: |

 Диарея у пациентов с СРК имеет ряд особенностей: она отсутствует ночью и возникает либо рано утром (при пробуждении больного) — так называемый симптом будильника или после приема пищи («гастроколитиче-ский» рефлекс, по определению старых авторов). Позывы на дефекацию носят часто императивный характер, что объясняется усилением двигательной функции кишечника и повышенным газообразованием. Такие больные плохо переносят легко бродящие продукты (молоко, черный хлеб, мороженое, виноград), тогда как кисломолочные продукты переносят хорошо точно так же как и вареное мясо, каши (особенно гречневую). Частота стула не превышает, как правило, 2—5 раз в день. Позывы на дефекацию возникают с небольшими интервалами в течение короткого времени. При первом акте дефекации стул может быть оформленным, при последующих актах — кашицеобразным и жидким. Общая масса выделенного кала обычно не превышает 200 г.
Диарея у пациентов с СРК имеет ряд особенностей: она отсутствует ночью и возникает либо рано утром (при пробуждении больного) — так называемый симптом будильника или после приема пищи («гастроколитиче-ский» рефлекс, по определению старых авторов). Позывы на дефекацию носят часто императивный характер, что объясняется усилением двигательной функции кишечника и повышенным газообразованием. Такие больные плохо переносят легко бродящие продукты (молоко, черный хлеб, мороженое, виноград), тогда как кисломолочные продукты переносят хорошо точно так же как и вареное мясо, каши (особенно гречневую). Частота стула не превышает, как правило, 2—5 раз в день. Позывы на дефекацию возникают с небольшими интервалами в течение короткого времени. При первом акте дефекации стул может быть оформленным, при последующих актах — кашицеобразным и жидким. Общая масса выделенного кала обычно не превышает 200 г.
 Холестатический синдром обусловлен внутрипеченочным холестазом ц повышением концентрации в крови и накоплением в тканях компонентов желчи. Клинические признаки синдрома: а) кожный зуд, от слабого до упорного, нестерпимого; б) желтуха; в) бурая пигментация кожи; г) ксантелазмы и ксантомы. Потемнение мочи и посветление кала для внутрипеченочного холестаза нехарактерно. Лабораторные признаки: 1) повышение в крови активности экскреторных ферментов: щелочной фосфатазы, у-глютамилтранс-пептидазы, 5-нуклеотидазы, 2) повышение в сыворотке крови содержания холестерина, (3-липопротеинов, фосфолипидов, желчных кислот.
Холестатический синдром обусловлен внутрипеченочным холестазом ц повышением концентрации в крови и накоплением в тканях компонентов желчи. Клинические признаки синдрома: а) кожный зуд, от слабого до упорного, нестерпимого; б) желтуха; в) бурая пигментация кожи; г) ксантелазмы и ксантомы. Потемнение мочи и посветление кала для внутрипеченочного холестаза нехарактерно. Лабораторные признаки: 1) повышение в крови активности экскреторных ферментов: щелочной фосфатазы, у-глютамилтранс-пептидазы, 5-нуклеотидазы, 2) повышение в сыворотке крови содержания холестерина, (3-липопротеинов, фосфолипидов, желчных кислот.