 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Сделайте вывод о химических свойствах бензена и нафталена, о сходстве и различии их химических свойств.
Контрольные вопросы:
1. Укажите тип гибридизации атомов углерода в бензеновом кольце. 2. Укажите, какие углеводороды вступили в реакцию, и при каких условиях, если в результате образовались следующие вещества: а) C 6H 5CH3 + HCI; б) C 6H 5CH 2CI + HCI; в) 12CO2 + 6H2О; г) C6H5COOH + H2O. 3. Напишите уравнения химических реакций получения толуена из метана. 4. Напишите структурные формулы изомеров гомологов бензена с молекулярной формулой C 9H12. Назовите их. 5. Напишите химические реакции, с помощью которых можно различить: а) бензен и циклогексан; б) бензен и 1-гексен; в) толуен и н-гептан; г)хлорбензен и этилбензен. 6. Напишите уравнения реакций следующих превращений, используя структурные формулы органических веществ: а) природный газ → ацетилен →бензен→ нитробензен ↓ циклогексан б) 1,6-дихлоргексан → циклогексан → бензен→ толуен → бензойная кислота; в) бензойная кислота → бензоат натрия → бензен → бромбензен ↓ этилбензен
Лабораторная работа № 5. СПИРТЫ, ФЕНОЛЫ, НАФТОЛЫ. Цель работы:изучение химических свойств гидроксилсодержащих углеводородов.
Оборудование: спиртовки, пробирки, газоотводные трубки, фильтровальная бумага. Реактивы:
Методика проведения исследования ОПЫТ 1. ОБРАЗОВАНИЕ И ГИДРОЛИЗ АЛКОГОЛЯТОВ НАТРИЯ. Выполнение работы.
В три сухие пробирки наливают по 5 капель спиртов: в первую – этиловый, во вторую – пропиловый или изопропиловый, в третью – амиловый или изоамиловый. В каждую пробирку вносят по маленькому кусочку очищенного от оксидного слоя металлического натрия. Отметьте, в какой пробирке реакция идет наиболее интенсивно, а в какой – медленно. По окончании реакций (пробирки закрыты пробками с газоотводными трубками) поджигают выделяющийся газ у отверстий газоотводных трубок. После полного растворения натрия добавляют в каждую пробирку по 1 капле фенолфталеина, отмечают цвет раствора, затем по каплям добавляют воду, пока раствор не примет розовую или красную окраски.
Химизм процесса:
Алкоголяты подобны солям очень слабых кислот и при действии воды гидролизуются с образованием спирта и щелочи.
ОПЫТ 2. РЕАКЦИИ ОКИСЛЕНИЯ СПИРТОВ.
Выполнение работы.
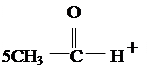
а) В сухую пробирку помещают 5 капель этилового спирта. Держа пинцетом, спираль из медной проволоки, нагревают ее в пламени горелки до появления черного налета оксида меди. Еще горячую спираль опускают в пробирку с этиловым спиртом. Черная поверхность спирали становится золотистой вследствие восстановления оксида меди. При этом ощущается запах уксусного альдегида (запах яблок). В отдельную пробирку помещают 3 капли раствора фуксинсернистой кислоты и добавляют 1 каплю полученного раствора. Появляется розово-фиолетовая окраска (цветная реакция на альдегиды). Химизм процесса:
б) В сухую пробирку помещают 2 капли этилового спирта, 2 капли раствора перманганата калия и 3 капли раствора серной кислоты. Нагревают. Розовый раствор обесцвечивается. Ощущается характерный запах ацетальдегида. В чистую пробирку помещают 3 капли раствора фуксинсернистой кислоты и 1 каплю обесцвеченного раствора, постепенно появляется розовая окраска.
Химизм процесса:
ОПЫТ 3. ПОЛУЧЕНИЕ ГЛИЦЕРАТА МЕДИ И ГЛИКОЛЯТА МЕДИ. Выполнение работы.
В две пробирки наливают по 3-4 капли раствора CuSO4 и по 4 капли раствора NaOH. К образовавшимся осадкам голубого цвета приливают: в одну пробирку 3-4 капли глицерина, в другую – 3-4 капли этиленгликоля. Осадки растворяются, и появляется окрашивание растворов в пробирках от образующихся комплексных соединений – глицерата меди и гликолята меди. Химизм процесса:
ОПЫТ 4. ПОЛУЧЕНИЕ ДИЭТИЛОВОГО ЭФИРА.
Выполнение работы.
В сухую пробирку вводят 5 капель этилового спирта и 5 капель серной кислоты. Смесь осторожно нагревают до побурения раствора. К горячей смеси осторожно добавляют еще 4 капли этилового спирта. Ощущается характерный запах диэтилового эфира.
Химизм процесса:
Реакция проходит в две стадии. Сначала спирт реагирует с серной кислотой, образуя кислый сложный эфир серной кислоты – этилсульфат, или этилсерную кислоту:
Этилсерная кислота
Если спирт берется в избытке, то образуется простой эфир:
+ H2O + H2SO4
Затем пробирку закрывают пробкой с газоотводной трубкой, имеющей оттянутый конец, снова осторожно нагревают пробирку и поджигают выделяющийся эфир.
ОПЫТ 5. ПОЛУЧЕНИЕ ФЕНОЛЯТА НАТРИЯ И РАЗЛОЖЕНИЕ ЕГО СОЛЯНОЙ КИСЛОТОЙ.
Выполнение работы.
В пробирку помещают 5 капель эмульсии фенола в воде и добавляют 3 капли раствора едкого натра. Образуется прозрачный раствор фенолята натрия. К половине прозрачного фенолята натрия добавляют 2 капли раствора соляной кислоты. Вновь выделяется свободный фенол в виде эмульсии.
Химизм процесса:
Фенолы обладают кислотными свойствами, они легко вступают в реакцию с водными растворами щелочей и образуют феноляты. При действии на фенолят натрия кислотой, даже такой слабой, как угольная, выделяется фенол.
ОПЫТ 6. ЦВЕТНЫЕ РЕАКЦИИ ФЕНОЛА И МНОГОАТОМНЫХ ФЕНОЛОВ С ХЛОРИДОМ ЖЕЛЕЗА.
Выполнение работы.
В одну пробирку вносят 3 капли раствора фенола, в другую – 3 капли раствора резорцина, в третью – 3 капли раствора гидрохинона, в четвертую – 3 капли раствора пирогаллола, в пятую – 3 капли раствора пирокатехина. В каждую из пробирок добавляют по 1 капле раствора хлорида железа. При этом в первой пробирке появляется красно-фиолетовое окрашивание, во второй – фиолетовое, в третьей – зеленое, переходящее в желтое, в четвертой – красное, в пятой – зеленое окрашивание. Фенолы с хлоридом железа в водном растворе дают цветные реакции вследствие образования окрашенных соединений типа C6H5OFeCl3. Эти реакции служат для качественного открытия фенолов.
ОПЫТ 7. ПОЛУЧЕНИЕ ТРИБРОМФЕНОЛА. Выполнение работы.
В пробирку вводят 2 капли бромной воды и добавляют каплю водного раствора фенола. При этом бромная вода обесцвечивается, и жидкость мутнеет вследствие образования белого осадка трибромфенола.
Химизм процесса:
ОПЫТ 8. ОКИСЛЕНИЕ ФЕНОЛОВ КИСЛОРОДОМ ВОЗДУХА В ЩЕЛОЧНОЙ СРЕДЕ.
Выполнение работы.
На полоску фильтровальной бумаги (10´3 см) наносят через равные промежутки по 1 капле растворов пирокатехина, резорцина, гидрохинона и пирогаллола. В центр каждого из полученных пятен помещают по капле раствора щелочи. Пятно пирокатехина мгновенно окрашивается в зеленый цвет, пятно пирогаллола – в темно-коричневый. Гидрохинон образует желтое пятно с зеленой каемкой по периферии. Резорцин только через некоторое время образует слабо выраженное кольцо коричневого цвета. Зеленое пятно пирокатехина постепенно начинает желтеть (происходит частичное окисление до о-хинона). Многоатомные фенолы легко окисляются под влиянием кислорода воздуха. Особенно быстро идет окисление фенолов в щелочном растворе.
ОПЫТ 9. ЦВЕТНЫЕ РЕАКЦИИ НАФТОЛОВ С ХЛОРИДОМ ЖЕЛЕЗА. Выполнение работы.
В пробирки помещают несколько кристаллов a-нафтола и добавляют 3 капли этилового спирта (нафтолы плохо растворимы в воде). К спиртовому раствору a-нафтола добавляют каплю хлорида железа – появляется фиолетовое окрашивание. Такой же опыт повторяют с b-нафтолом. b-нафтол дает сначала зеленоватое окрашивание, а затем выпадает белый осадок.
Поиск по сайту: |
 2C2H5OH + 2Na 2C2H5ONa + H2
2C2H5OH + 2Na 2C2H5ONa + H2 C2H5ONa + H-OH C2H5OH + NaOH
C2H5ONa + H-OH C2H5OH + NaOH











 CH3-CH2OH + HO-SO3H CH3-CH2-OSO3H + H2O
CH3-CH2OH + HO-SO3H CH3-CH2-OSO3H + H2O CH3—CH2—O—SO3H + HO—CH2—CH3 СH3—CH2—O—CH2—CH3 +
CH3—CH2—O—SO3H + HO—CH2—CH3 СH3—CH2—O—CH2—CH3 +
 C6H5OH + NaOH C6H5ONa + H2O
C6H5OH + NaOH C6H5ONa + H2O C6H5ONa + HCl C6H5OH + NaCl
C6H5ONa + HCl C6H5OH + NaCl





