 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Опыт проводят в вытяжном шкафу.
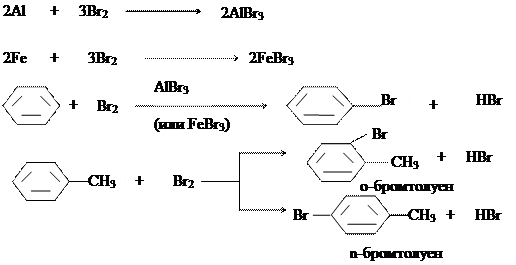
В 4 пробирки приливают по 3 капли исследуемого углеводорода (опыт проводят с бензеном и толуеном параллельно) и по 1 капле раствора брома. В первую пробирку помещают кристаллик йода, во вторую - немного железных опилок, в третью - кусочек амальгамированной алюминиевой проволоки. В четвертую пробирку катализатор не добавляют. В четырех пробирках, содержащих бензен, на холоду не обнаруживают изменений. Поэтому их нагревают в водяной бане сначала до начала кипения, а затем ставят в штатив. Выделение бромоводорода наблюдается в присутствии алюминия и железа. Пробирки с толуеном оставляют в штативе при комнатной температуре, часто взбалтывая. Бромирование толуена идет значительно легче, чем бромирование бензена. Химизм процесса:
Принизких температурах в присутствии катализаторов галоген легко замещает водородные атомы бензенового ядра. В качестве катализаторов применяются галогениды металлов, сера, йод. Самыми сильнодействующими катализаторами являются соединения алюминия с галогенами. В их присутствии можно все атомы водорода ядра заменить на атомы хлора или брома. Катализаторы помогают созданию активной электрофильной частицы путем поляризации связи между атомами галогена:
δ+ δ-
ОПЫТ 9. БРОМИРОВАНИЕ СТИРЕНА.
Выполнение работы. В вытяжном шкафу очень осторожно готовят раствор брома в ледяной уксусной кислоте. В пробирку помещают 3 капли стирена и при постоянном перемешивании по 1 капле добавляют раствор брома до тех пор, пока очередная капля брома не перестанет обесцвечиваться. К полученному раствору добавляют 5 капель холодной воды, через некоторое время выпадет белый осадок фенилдибромэтана. Химизм процесса:
В этих условиях идет постепенное присоединение брома по месту двойной связи в боковой цепи. ОПЫТ 10. ПРОЧНОСТЬ ГАЛОГЕНА, СТОЯЩЕГО В БЕНЗЕНОВОМ КОЛЬЦЕ.
Выполнение работы.
В пробирку помещают 1 каплю хлорбензена, 5 капель воды и нагревают до кипения. К горячему раствору приливают 1 каплю раствора соли серебра. Появления белого осадка или мути хлорида серебра не происходит. Это подтверждает прочность связи с ядром галогена. Атом галогена сопряжен с бензеновым ядром. В результате образуется частичная двоесвязанность С-HaI, которая приводит к уменьшению длины связи и возрастанию ее энергии. Сопряжение уменьшает полярность связи С-НаI и тем самым затрудняет условия для протекания реакций замещения. Подвижность галогена в ядре увеличивают электроноакцепторные заместители. Например, нитрогруппа в пара- или орто-положении к галогену.
ОПЫТ 11. ЛЕГКАЯ ПОДВИЖНОСТЬ ГАЛОГЕНА, СТОЯЩЕГО В БОКОВОЙ ЦЕПИ.
Выполнение работы.
В пробирку помешают 1 каплю хлористого бензила, 5 капель воды, нагревают до кипения и прибавляют 1 каплю раствора нитрата серебра. Немедленно выпадает белый осадок хлорида серебра. Химизм процесса:
хлористый бензил бензиловый спирт
Атом галогена у α - углеродного атома боковой цепи обладает большой подвижностью.
Сделайте сравнительный вывод о химических свойствах галогенпроизводных алифатического и ароматического рядов. Отметьте отличительные особенности галогена в ароматических углеводородах (подвижность галогена в боковой цепи и прочную связь галогена в ядре).
Контрольные вопросы.
1. Напишите общую формулу моногалогенпроизводных предельных углеводородов. 2. От чего зависит изомерия галогенпроизводных? 3. Каким образом можно получить галогенпроизводные из предельных углеводородов, олефинов, спиртов? Напишите уравнения соответствующих реакций. 4.От каких факторов зависят физические свойства галогенроизводных? 5. Напишите уравнения химический реакций моногалогенпроизводных, характеризующие их химические свойства. 6. Какое техническое значение имеют галогенпроизводные непредельных углеводородов? 7. На какие две группы разделяются по строению, свойствам и методам получения ароматические углнводороды? Как отличаются по реакционной способности галогеналкилы от простых галогенарилов? 8. Расскажите о правилах ориентации в бензеновом кольце. Приведите примеры. 9. Из бензена получите м-хлорнитробензен; п-бромнитробензен; 3,5-дибромнитробензен. 10. Напишите структурные формулы п-хлортолуена; о-бромбензойной кислоты; м-броманилина; 1,1-дихлорэтана; 1,2-дихлорэтана; 1,1,1,2-тетрахлорэтана; 1,1,2,2-тетрахлорэтана. Предложите схему систеза п-хлортолуена. 11. Как влияет применение катализаторов при галогенировании ароматических соединений?
ЛАБОРАТОРНАЯ РАБОТА № 9.
Поиск по сайту: |
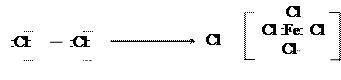
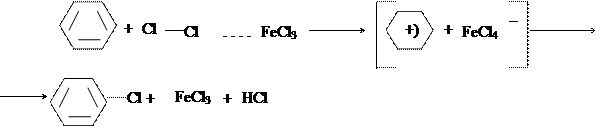 δ+ δ-
δ+ δ-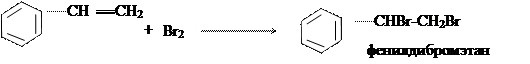
 C6H5-CH2Cl + HOH C6H5-CH2OH + HCl
C6H5-CH2Cl + HOH C6H5-CH2OH + HCl HCl + AgNO3 AgCl + HNO3
HCl + AgNO3 AgCl + HNO3