|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Сделайте вывод о химических свойствах аминокислот.⇐ ПредыдущаяСтр 12 из 12
Контрольные вопросы.
1. Какие функциональные группы содержат аминокислоты? 2.Расскажите об изомерии и номенклатуре аминокислот. 3. Что такое биполярный ион? Как он ведет себя в кислой и щелочной средах? 4. Расскажите о способах получения ά-аминокислот. 5. Какие соединения дают γ- и δ-аминокислоты? 6. Для лейцина, глицина и аланина напишите их химические названия, уравнения диссоциации в водном растворе, состояние ионизации в сильно кислой и сильно щелочной средах; определите, в какой среде находятся их изоэлектрические точки. Напишите уравнения реакций каждой из аминокислот с HCI, KOH,HNO 2,CH 3OH при нагревании. 7. Какие соединения называются аминокислотами? Напишите примеры следующих аминокислот: моноаминомонокарбоновой, диаминомонокарбоновой, моноаминодикарбоновой. Для них приведите реакции с HCI, NaOH. Назовите полученные соединения. 8. Напишите уравнения реакций получения α-аминомасляной кислоты из соответствующего альдегида. Напишите уравнения реакций ее взаимодействия с азотистой кислотой, с двумя молекулами глицина. 9. Получите дипептид из фенилаланина и лизина. В какой среде лежит его изоэлектрическая точка? 10. Сравните химические свойства, обусловленные наличием аминогруппы, в следующих соединениях: этиламине, ацетамиде, аминоуксусной кислоте. ЛАБОРАТОРНАЯ РАБОТА № 11.
МОНОСАХАРИДЫ
Цель работы: изучение химических свойств моносахаридов.
Оборудование: спиртовки, пробирки, пипетки. Реактивы:
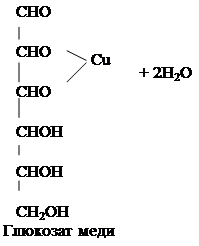
Методика проведения исследования. ОПЫТ 1 . ОБЩАЯ РЕАКЦИЯ НА УГЛЕВОДЫС α– НАФТОЛОМ (Реакция Молиша). Выполнение работы. В отдельные пробирки помещают по 0,1 г различных углеводов: глюкозу, фруктозу, сахарозу, крахмал, клетчатку (маленький кусочек фильтровальной бумаги размером 2-3 мм2).В каждую пробирку прибавляют по 10 капель воды и 3-4 капли спиртового раствора α- нафтола. Содержимое пробирок перемешивают и осторожно, чтобы жидкость не смешивалась, добавляют по 7-10 капель концентрированной серной кислоты, которая при этом опускается на дно пробирки. На границе двух слоев наблюдается красно-фиолетовое кольцо. При взбалтывании смесь разогревается и окрашивается по всему объему, а при разбавлении ее водой выделяются окрашенные хлопья. Реакцию с α-нафтолом дают все углеводы. Появление окраски обусловлено расщеплением молекулы углевода при действии концентрированной серной кислоты с образованием фурфурола или его производных, которые вступают в реакцию конденсации с α- нафтолом, образуя окрашенные вещества. ОПЫТ 2. ДОКАЗАТЕЛЬСТВО НАЛИЧИЯ ГИДРОКСИЛЬНЫХ ГРУПП В ГЛЮКОЗЕ. Выполнение работы. В пробирку помещают 1 каплю раствора глюкозы и 5 капель раствора едкого натра. К полученной смеси добавляют 1 каплю раствора сульфата меди (II) и встряхивают содержимое пробирки. Образующиеся вначале голубоватый осадок гидроксида меди (II) Cu(OH)2 мгновенно растворяется и получается прозрачный раствор сахарата меди, имеющий слабую синюю окраску: CuSO4 + 2NaOH Cu(OH)2 + Na2SO4
Моносахариды взаимодействуют с гидроксидами, а также с оксидами тяжёлых металлов, подобно многоатомным спиртам. При этом водород гидроксильных групп замещается на металл, и образуются производные моносахаридов типа алкоголятов, называемые сахаратами. Растворение гидроксида меди (II) Cu(OH)2 доказывает наличие гидроксильных групп в глюкозе. Полученный раствор сохраняют для следующего опыта.
ОПЫТ 3. ОКИСЛЕНИЕ ГЛЮКОЗЫ ГИДРОКСИДОМ МЕДИ (П) В ПРИСУТСТВИИ ЩЕЛОЧИ (РЕАКЦИЯ ТРОММЕРА). Выполнение работы. К полученному в предыдущем опыте щелочному раствору сахарата меди добавляют 5-6 капель воды. Содержимое пробирку нагревают над пламенем горелки, держа пробирку наклонно, так чтобы нагревалась только верхняя часть раствора, а нижняя оставалась без нагрева (для контроля). При осторожном нагревании до кипения нагретая часть синего раствора окрашивается в оранжево-жёлтый цвет вследствие образования гидроксида меди (I) CuOH. При более продолжительном нагревании может образоваться красный осадок оксида меди (I) Cu2O. Химизм процесса:
2CuOH Cu2O + H2O
Положительную реакцию Троммера дают только те углеводы, которые имеют свободный гликозидный гидроксил, то есть все моносахариды, а из дисахаридов- мальтоза, лактоза. Углеводы, не имеющие свободной альдегидной или кетонной группы, то есть сахароза, крахмал, гликоген и другие, реакции Троммера не дают
ОПЫТ 4. ОКИСЛЕНИЕ ГЛЮКОЗЫ РЕАКТИВОМ ФЕЛИНГА. Выполнение работы. В пробирку вносят 3 капли раствора глюкозы и каплю реактива Фелинга. Содержимое пробирки осторожно нагревают в пламени горелки. При этом наблюдается изменение окраски жидкости, выделение жёлтого осадка,переходящего в красный осадок закиси меди. Реакция фелинговой жидкости с глюкозой протекает весьма сложно, но сводится к окислению глюкозы и образованию закиси меди:
Жидкость Фелинга служит для обнаружения карбонильной группы в сахарах. Положительную реакцию о фелинговой жидкостью дают те же углеводы, которые дают положительную реакцию Троммера.
ОПЫТ 5. ОБРАЗОВАНИЕ "СЕРЕБРЯНОГО ЗЕРКАЛА".
Выполнение работы.
В пробирку помещают каплю раствора нитрата серебра, 2 каплираствора едкого натра и приливают по каплям раствор аммиака до растворения образовавшегося осадка гидроксида серебра. Затем добавляют I каплю раствора глюкозы и слегка подогревают содержимое пробирки над пламенем горелки до начала почернения раствора. Дальше реакция идет без нагревания и металлическое серебро выделяется на стенках пробирки в виде блестящего зеркального налёта. Химизм процесса:
Моносахариды легко окисляются, причем в зависимости от условий получаются разнообразные продукты окисления. При осторожном окислении альдоз в кислой или нейтральной среде образуются альдоновые кислоты (одноосновные многоатомные оксикислоты). Кетозы (например, фруктоза) в этих условиях не окисляются. При окислении моносахаридов в щелочном растворе не удаётся выделить продукты окисления с тем же числом углеродных атомов. Окисление оксидом серебра в щелочной среде служит качественной реакцией на моносахариды.
ОПЫТ 6. ОКИСЛЕНИЕ МОНОСАХАРИДОВ БРОМНОЙ ВОДОЙ.
Выполнение работы.
В одну пробирку вносят 5 капель глюкозы, в другую - 5 капель фруктозы. В каждую пробирку добавляют по 10 капель бромнойводы исмесь нагревают на кипящей водяной бане в течете 15 мин.Если за это время окраска не исчезнет, то кипятят жидкость 0,5-1 мин. на пламени горелки до полного обесцвечивания. Охладив оба полученных раствора (содержавших глюкозу и фруктозу) в воде до комнатной температуры, добавляют к каждому из них по несколько капель раствора хлорного железа и сравнивают появившуюся в них окраску. В кислой среде окисление сахаров протекает довольно медленно: при этом алъдогексозы превращаются в полиоксикислоты, сначала в одноосновные, затем в двухосновные. Глюкоза в условиях опыта дает одноосновную глюконовую кислоту:
H Глюконовая кислота имеет 5 гидроксильных групп, в том числе одну в α-положении к карбоксилу, идает характерную дляα -оксикислот цветную реакцию. Кетогексозы более устойчивы к действию окислителей: фруктоза в условиях опыта почти не окисляется. Кетогексозы при более энергичномокислениираспадаются, давая оксикислоты с меньшим числом атомов углерода.
ОПЫТ 7. ОКИСЛЕНИЕ АЛЬДОЗЫ И КЕТОЗЫ ЙОДОМ. Выполнение работы. Опыт проводят параллельно с растворами глюкозы и фруктозы. К 5 каплям каждого из растворов добавляют одновременно по 1 капле раствора йода и затемразбавляют щелочь (одинаковое число капель) до обесцвечивания смеси: отмечают по часам время добавления щелочи и ставят обе пробирки в штатив. Через 7-8 минут приливают в обе пробирки по 1 капле разбавленной серной кислоты и сравнивают появившуюся окраску. Химизм процесса:
Добавление кислоты, которая связывает щелочь, сдвигает равновесие реакции влево. Однако за время опыта в растворе альдозы-глюкозы большая часть гипоиодита успевает израсходоваться на окисление глюкозы до глюконовой кислоты, и при подкислении смеси свободный йод уже почти не выделяется. Кетоза-фруктоза окисляется медленнее: за то же время йодноватистокислая соль почти не исчезает, и подкислении выделчяетя свободный йод. При более длительном стоянии гипойодит постепенно расходуется и в растворе, содержащем фруктозу.
ОПЫТ 8. ДЕЙСТВИЕ ЩЕЛОЧЕЙ НА МОНОСАХАРИДЫ.
Выполнение работы.
В пробирку наливают 10 капель 10%-ного раствора глюкозы, добавляют равный объем 20-30%-ного раствора едкого натра и осторожно нагревают до кипения. Раствор желтеет. При более продолжительном нагревании жидкость приобретает бурую окраску, и, наконец, осмоляется.
ОПЫТ 9 . РЕАКЦИЯ МОНОСАХАРИДОВ С МИНЕРАЛЬНЫМИ КИСЛОТАМИ.
Выполнение работы. а) Несколько крупинок глюкозы и фруктозы растворяют в отдельных пробирках в 1-2мл воды. К холодному раствору осторожно, по стенкам пробирки добавляют равный объем концентрированной серной кислоты, стараясь не взболтать смесь. Серная кислота образует нижний, тяжелый слой под раствором сахара. На границе этих слоев постепенно появляется темно-бурое кольцо. Если на холоде кольца не образуется, слегка подогревают содержимое пробирки, не взбалтывая его.
б) Небольшое количество какой-либо альдопентозы кипятят с 2 мл концентрированной соляной кисты. При этом происходит дегидратация альдопентозы и переход ее в фурфурол.
Образовавшийся фурфурол открывают прибавлением к продуктуреакции несколько капель анилина н уксуснойкислоты. Получается красивое розовое окрашивание.
H
Левулиновая кислота
ОПЫТ 10. РЕАКЦИЯ СЕЛИВАНОВА НА КЕТОЗЫ. Выполнение работы. Опыт одновременно проводят с растворами глюкозы и фруктозы. К 0,5-1 мл каждого из растворов добавляют 2 мл реактива Селиванова, после чего погружают все пробирки на 2 мин в кипящую водяную баню. Раствор фруктозы быстро окрашивается в ярко красный цвет. Окраска зависит от взаимодействия образующегося оксиметилфурфурола с резорцином. Альдогексозы в этих условиях реагируют гораздо медленнее, и раствор окрашивается лишь в слабо-розовый цвет.
Сделайте вывод о химических свойствах моносахаридов.Какие химические свойства характерны для альдоз и кетоз?
Контрольные вопросы. 1. Наличие, каких функциональных групп характерны для альдоз и кетоз? 2. Что такое моносахариды? Что такое гексозы и пентозы? 3.Напишите химические реакции моносахаридов с участием гидроксильных групп и альдегидной группы. 4. Напишите уравнения химический реакций, характеризующих специфические свойства глюкозы. 5. Какие вещества называются эпимерами? 6. Какие продукты получаются при восстановлении моноз? 7. Какие продукты образуются при алкилировании и ацелировании глюкозы? Напишите соответствующие уравнения реакции и назовите полученные соединения. 8. Напишите формулу L-глюкозы в циклической и оксикарбонильной формах. 9. В чем заключается явление таутомерии? Объясните на примере L-глюкозы. 10. Какое практическое применение имеют моносахара?
ЛАБОРАТОРНАЯ РАБОТА № 12.
ДИСАХАРИДЫ И ПОЛИСАХАРИДЫ.
Цель работы: изучение химических свойств дисахаридов и полисахаридов.
Оборудование: поляриметр, технохимические весы, электроплитка, асбестовая сетка, фарфоровые выпарительные чашки, водяная баня, спиртовки, конические колбы вместимостью 250 мл, мерные колбы вместимостью 100 мл, химические воронки, бюксы, шпатель, химические стаканчики, пробирки, часовые стекла, фильтровальная бумага, мерные цилиндры, индикаторная фенолфталеиновая бума, пинцет, термометр, стеклянные палочки..
Реактивы:
Методика проведения исследования: ОПЫТ 1. ДОКАЗАТЕЛЬСТВО НАЛИЧИЯ ГИДРОКСИЛЬНЫХ ГРУПП В САХАРОЗЕ.
Выполнение работы. В пробирку помещают 5 раствора сахарозы, 10 капель раствора щелочи и 10 капель воды. Добавляют каплюраствора сульфата меди (II). Смесьприобретает слабую синеватую окраскувследствие образованиясахарата меди. Раствор сахарата меди осторожно нагревают до кипения над пламенем горелки, держа пробирку так, чтобы нагревалась только верхняя часть раствора. Сахароза в этих условиях не окисляется, что указывает на отсутствие в ее молекуле свободной альдегидной группы.
ОПЫТ 2. ОТНОШЕНИЕ ДИСАХАРИДОВ К ФЕЛИНГОВОЙ ЖИДКОСТИ.
Выполнение работы.
В три пробирки наливают по 2 мл фелинговой жидкости.В одну прибавляют 2 мл раствора сахарозы, в другую - 2 мл раствора лактозы и в третыо - 2 мл раствора мальтозы. Все три пробирки нагревают одновременно на кипящей водяной бане в течение 1-2 минут. В пробирках с мальтозой и лактозой фелигова жидкость восстанавливается с образованием красного осадка закиси меди. В пробирке с раствором сахара изменений не наблюдается, что указывает на неспособность сахарозы к реакциям восстановления, так как она не имеет ни свободных гликозидных гидроксилов, ни карбонильных групп.
Лактоза и мальтоза относятся к сахарам. При нагревании одно из окисных колец в молекуле разрывается и образуется альдегидная группа, которая окисляется до карбоксильной, а фелингова жидкость восстанавливается с образованием закиси меди.
У сахарозы связь между остатками глюкозы и фруктозы образована за счет двух гликозидных гидроксилов, поэтому она не способна к реакциям восстановления фелинговой жидкости.
ОПЫТ 3. ОТНОШЕНИЕ ДИСАХАРИДОВ К АММИАЧНОМУ РАСТВОРУ ОКИСИ СЕРЕБРА.
Выполнение работы.
В три чистые пробирки, вымытые горячей щелочью с водой, наливают по 3 мл аммиачного раствора окиси серебра. В одну из них прибавляю 2 мл 2%-ного раствора лактозы, во вторую 2 мл 2%-ного мальтозы и в третью 2 мл 2%-ного раствора сахарозы. Все три пробирки помещают на несколько минут в стакан с водой, нагретой до 80-90°. Если стенки пробирки достаточно хорошо вымыты, то в первом в во втором случаях наблюдается выделение металлического серебра в виде серебряного зеркала. В пробирке с раствором сахарозы измененийне наблюдается, что указывает на нестабильность сахарозы к реакциям восстановления.
ОПЫТ 4. ГИДРОЛИЗ (ИНВЕРСИЯ) САХАРОЗЫ.
Выполнение работы.
В пробирку помещают 4 мл 2%-ного раствора сахарозы, несколько капель разбавленной серной кислоты и кипятят в течение 3-5 минут. Часть полученного таким образом раствора инвертного сахара после его охлаждения нейтрализуют раствором едкого натра до слабо щелочной реакции, добавляют фелинговой жидкости и вновь нагревают. Моносахариды, образовавшиеся в результате гидролиза, восстанавливают фелинговую жидкость с выделение красного осадка закиси меди:
Со второй частью кислого гидролиза проделывают реакцию Селиванова. К раствору добавляют концентрированной соляной кислоты, кристаллик резорцина и нагревают. Появление вишнево-красного окрашивания указывает на присутствие в гидролизе фруктозы.
ОПЫТ 5. ОПРЕДЕЛЕНИЕ УДЕЛЬНОГО ВРАЩЕНИЯ ГЛЮКОЗЫ И САХАРОЗЫ.
Выполнение работы.
УСТРОЙСТВО И ПРИНЦИП ПОЛЯРИМЕТРА. Удельное вращение оптически активных веществ определяют с помощью поляриметра. Поляриметры бывают различных систем, но большинство из них построено по определенной схеме. Луч света от источника света 1 (рис. 1) проходит последовательно через желтый светофильтр 2, поляризатор 3, где свет поляризуется, через трубку 4 (для исследуемого раствора), анализатор 5 и окуляр 6 с лупой для наведения на фокус. Если обе призмы (поляризатор и анализатор) установлены параллельно и трубка 4 наполнена оптически недеятельным веществом, то поляризованный луч света проходит через нее и поле зрения будет освещено. Если же в трубку 4 помещено оптически активное вещество, то оно вызывает отклонение плоскости поляризации на некоторый угол α, вследствие чего свет только частично пройдет через анализатор и поле зрения затемнится. Поворачивая анализатор с помощью связанного с ним рычага, можно снова получать полное освещение поля зрения, Угол, на который приходится поворачивать анализатор, равен углу,на который отклоняется плоскость поляризации оптически деятельным веществом. Нулевой точкой прибора считают такое положение анализатора, при котором обе половины поля анализатора освещены равномерно, а по диаметру его расположена едва заметная линия раздела. Нулевую точку находят, слегка вращая анализатор. Если при исследовании оптически активного вещества для получения однородно освещенного поля анализатор поворачивают вправо (по часовой стрелке), то вещество называют правовращающим и вращение обозначают знаком л+л (плюс). Если же анализатор поворачивает влево (против часовой стрелки), то это указывает на левое вращение, обозначаемое знаком "-" (минус). При определении нулевой точки и исследовании оптической активности вещества делают несколько (4-5) отсчетов, берут среднее значение.
ОПРЕДЕЛЕНИЕ УДЕЛЬНОГО ВРАЩЕНИЯ ГЛЮКОЗЫ И САХАРОЗЫ.
Сначала определяют нулевую точку прибора. Для этого в трубку поляриметра наливают дистиллированную воду. Пузырьки воздуха мешают определению. Если в трубке окажется пузырек, то наклоном трубки его перемещают в расширение 4. Заполненную трубку помещают в желоб поляриметра между поляризатором и анализатором, с помощью выдвижного окуляра получают резкое изображение поля зрения и, медленно вращая анализатор, устанавливают нулевую точку по равномерной освещенности поля. Целое число градусов отсчитывают по верхней шкале, а десятые доли градуса - по нижней шкале (нониусу). Значение нулевой точки алгебраически вычитают из величины угла вращения, найденного при исследовании вещества.
Рис.1. Схема устройства поляриметра: 1-источник света; 2- желтый светофильтр; 3- поляризатор (призма Николя); 4 - трубка для исследуемого раствора; 5 – анализатор (трубка Николя); 6 - окуляр с лупой для наведения на фокус.
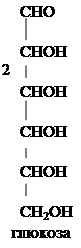
Раствор α-Д-глюкозы готовят непосредственно перед измерением угла вращения, так как в водном растворе глюкозы с течением времени величина угла вращения изменяется вследствие мутаротации. Отвешивают в бюксе 4,5-5,0 г глюкозы с точностью до 0,01 г. Навеску переносят в мерную колбу емкостью 100 мл, растворяют глюкозу в дистиллированной воде и доводят раствор до метки. Выливают воду из трубки поляризатора, споласкивают ее 2-3 раза раствором глюкозы и наполняют. Определяют угол вращения раствора глюкозы. Из найденного угла вращения вычитают поправку - значение нулевой точки. В другой мерной колбе на 100 мл растворяют в воде 5 г сахарозы. Трубку поляриметра ополаскивают 2-З раза раствором сахарозы, затем наполняют ее и определяют угол вращения. Оставляют раствор сахарозы в трубке поляриметра и через 1-1.5 ч снова определяют угол вращения. Убеждаются, что он остается постоянным (раствор сахарозы не мутаротирует). Величина угла вращения оптически деятельного вещества зависит от ряда факторов: от природы вещества, концентрации раствора, температуры, толщины слоя раствора, через которую проходит луч света, длины волны поляризованного света, от природы растворителя. Поэтому определяют удельное вращение /α/, которое при конкретных условиях является постоянной величиной (константой данного вещества). Удельным вращением называет угол вращения (в градусах) плоскости поляризации, которое вызывает раствор, содержащий в 1 мл 1 г оптически активного вещества при толщинеслоя раствора в 1 дм. Обычно при исследований указывают температуру раствора и длину волны света: например,
где α - найденный в опыте угол вращения; m -количество граммов вещества в 100 мл раствора; l -толщина слоя раствора, выраженная в дециметрах. Рассчитайте удельное вращение сахарозы и α-Д-глюкозы и сравните полученные величины с указанными в справочнике.
ОПЫТ 6. КИСЛЫЙ ГИДРОЛИЗ КРАХМАЛА.
Выполнение работы.
В коническую колбу емкостью 50 мл 20-25 мл 1%-ого крахмального клейстера и 5 мл 10%-ной серной кислоты. В 7-8 пробирок пробирок наливают по 1 мл очень разбавленного раствора йода в иодиде калия (светло-желтого цвета), пробирки ставят в штатив. В первую пробирку вносят 1-3 капли подготовленного для опыта раствора крахмала. Отмечают образовавшуюся окраску. Затем колбу нагреваютна асбестовой сетке небольшим пламенем горелки. Через 30 секунд после начала кипения отбирают пипеткой вторую пробу раствора, которую вносят во вторую пробирку с растворов йода, после встряхивания отмечают цвет раствора. В дальнейшем отбирают пробу раствора через каждые 30 сек. и вносят их в последующие пробирки с растворомйода. Отмечают постепенноеязменение окраски растворов при реакции с йодом. Изменение окраски происходит в следующем порядке:
После того как реакционная смесь перестанет давать окраску с йодом, смесъ кипятят еще 2-Змин, после чего ее охлаждают и нейтрализуют 10 %-ным раствором гидроксида натрия, добавляя его по каплям до щелочной реакции среды (появление розовой окраски на фенолфталеиновой индикаторной бумаге). Часть щелочного раствора переливают в пробирку, смешивают с равным объемом реактива Фелинга и нагревают. Выпадает красный осадок оксида меди (I). Химизм процесса:
крахмал декстрины мальтоза n C6H12O6 Д-глюкоза Итак, гидролиз крахмала под влиянием кислот происходит ступенчато, с образованием промежуточных продуктов гидролиза декстринов, которые гидролизуются дальше до мальтозы, а последняя до глюкозы. Амилодекстрины с раствором йода дают фиолетовое окрашивание, эритродекстрины дают красно-бурое окрашивание, ахродекстрины с раствором йода окрашивания не дают.
ОПЫТ 7. ПОЛУЧЕНИЕ АЗОТНОКИСЛЫХ ЭФИРОВ КЛЕТЧАТКИ.
В пробирку помещают 4 капли азотной кислоты и 8 капель серной кислоты. Горячий раствор слегка охлаждают и погружают в него при помощи стеклянной палочки маленький кусочек ваты. Пробирку нагревают на водяной бане при температуре 700С, осторожно помешивая палочкой вынимают образовавшийся коллоксилин, тщательно промывают проточной водой, отжимают в фильтровальной бумаге и сушат в фарфоровой чашечке на кипящей бане. Полученный желтоватый коллоксилин делят на две частя. Кусочек коллоксилиновой ваты подносят к пламени горелки -она мгновенно вспыхивает. Другой кусочек коллоксилиновой ваты помещают в сухую пробирку, добавляют 4 капли смеси спирта и эфира 1:1 и перемешивают. Коллоксилин набухает и образует коллоидный раствор, называемый коллодием. Коллодий выливают на предметное стекло. После испарения растворителя образовавшуюся тонкую пленку снимают со стекла и вносят в пламя горелки. Пленка коллодия сгорает медленнее, чем коллоксилиновая вата. Химизм процесса:
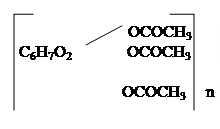
ОПЫТ 8. ПОЛУЧЕНИЕ ТРИАЦЕТАТА КЛЕТЧАТКИ. Оборудование:оптическое стекло; стеклянная палочка; химический стаканчик; фильтровальнаябумага; водяная баня; фарфоровая чашечка;часовое стекло. Реактивы: клетчатка (вата); уксусный ангидрид; уксуснаякислота ледяная; ацетон; хлороформ; серная кислота d=1,84 г/см3.
В пробирку помещают 5 капель уксусного ангидрида, 5 капель ледяной уксусной кислоты и 1 каплю серной кислоты. Небольшой кусочек ваты тщательно в течение нескольких минут смачивают водой, отжимают и расщипывают. В приготовленную смесьвату вводят в несколько приемов. При этом смесь сильно разогревается, и ее охлаждают холодной водой. Когда разогревание смеси прекратится, пробирку ставят в горячую воду и перемешивают содержимое стеклянной палочкой до полного растворения клетчатки. Полученный раствор выливают в стаканчик с 25 мл холодной воды. Выпавшие хлопья отжимают в фильтровальной бумаге, расщипывают и подсушивают в фарфоровой чашечке на кипящей бане. Небольшую часть полученного сухого триацетата клетчатки помещают в пробирку, добавляют 4 капли ацетона и медленнонагревают дослабогокипения 1-2 мин. Полученный раствор выливают на предметное стекло. После испарения ацетона на стекле остается пленка. Химизм процесса:
Поиск по сайту: |


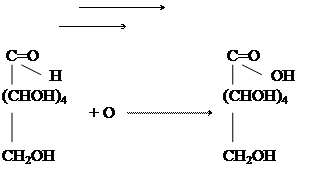 2Cu(OH)2 2CuOH + H2O + O2
2Cu(OH)2 2CuOH + H2O + O2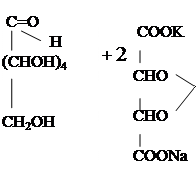
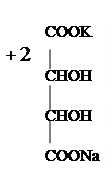
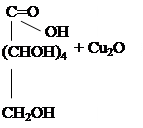
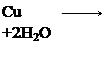

 Br2 + H2O HBr + HOBr
Br2 + H2O HBr + HOBr CH2OH(CHOH)4C=O + HOBr CH2OH(CHOH)4COOH + HBr
CH2OH(CHOH)4C=O + HOBr CH2OH(CHOH)4COOH + HBr
 I2 + 2NaOH NaI + NaOI + H2O
I2 + 2NaOH NaI + NaOI + H2O CH2OH(CHOH)4C=O + NaOI CH2OH(CHOH)4COOH + NaI
CH2OH(CHOH)4C=O + NaOI CH2OH(CHOH)4COOH + NaI H
H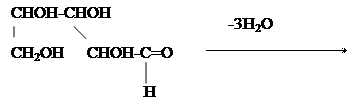



 HOH2C-CHOH-CHOH-CHOH-CHOH-C=O
HOH2C-CHOH-CHOH-CHOH-CHOH-C=O



 CH3-CO-CH2-CH2-COOH + H-COOH
CH3-CO-CH2-CH2-COOH + H-COOH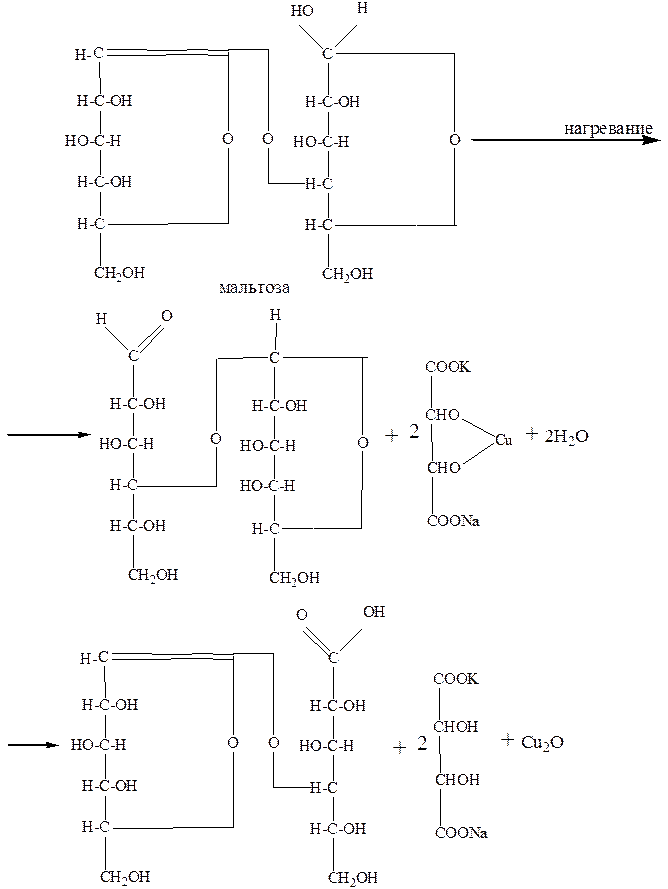
















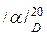 означает, что определение удельного вращения проводили при 200С в свете желтого натриевого пламени (спектральная линия Д). Удельное вращение рассчитывают по формуле:
означает, что определение удельного вращения проводили при 200С в свете желтого натриевого пламени (спектральная линия Д). Удельное вращение рассчитывают по формуле: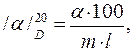
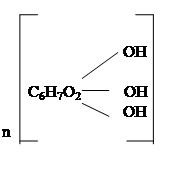
 (C6H10O5)n (C6H10O5)x 1/2n C12H22O11
(C6H10O5)n (C6H10O5)x 1/2n C12H22O11