 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Элементарная боровская теория атома водорода
Теория Бора, как уже было сказано основана на следующих допущениях-постулатах: 1. Атомная система имеет дискретные устойчивые стационарные состояния с определенной энергией, которые можно рассматривать с помощью обычной механики, но в которых система не излучает, даже если она должна излучать по законам классической электродинамики. 2. Излучение происходит при переходе из одного стационарного состояния в другое в виде кванта энергии 3. В специальном случае движения по круговым орбитам стационарными являются только те орбиты, на которых момент количества движения Р электрона кратен величине
где n = 1, 2, 3,...; me – масса электрона, rn – радиус n-ой орбиты; Vn – скорость электрона на n-ой орбите. Число п называется главным квантовым числом. Рассмотрим электрон, движущийся в поле атомного ядра с зарядом Ze. При Z =1 такая система соответствует атому водорода, при иных Z – водородоподобному иону, т. е. атому с порядковым номером Z, из которого удалены все электроны, кроме одного. Согласно второму закону Ньютона произведение массы электрона me на его центростремительное ускорение V2/r должно равняться кулоновской силе:
Исключая V из (1) и (2), получаем, что радиус электронных орбит в атоме может принимать лишь ряд дискретных значений:
Для первой орбиты водородного атома (Z = 1, п =1) получается Внутренняя энергия атомаслагается из кинетической энергии электрона (ядро неподвижно) и энергии взаимодействия электрона с ядром (потенциальной энергии): Наконец, учтя значения r, даваемые (3), получим дозволенные значения энергии электрона в атоме:
Схема энергетических уровней, определяемых (4), дана на рис. 1.
Рис. 1.
При переходе атома водорода из состояния п в состояние m испускается квант Таким образом, мы пришли к обобщенной формуле Бальмера, причем для постоянной Ридберга получается значение:
Величина R несколько отличается от значения постоянной Ридберга, найденной из спектроскопических измерений. Дело в том, что при выводе формулы (4) мы предполагали ядро неподвижным, тогда как в силу конечности своей массы оно вместе с электроном движется вокруг их общего центра инерции. Чтобы учесть это обстоятельство, достаточно вместо массы электрона ввести приведенную массу электрона и ядра:
где M - масса ядра. Заменяя в (4) me на m, получаем в случае атома водорода (M = Mp):
что прекрасно согласуется с экспериментом 109737,309±0,012 см-1. Здесь Rµ соответствует бесконечно большой массе ядра и совпадает с (5). Выражение (7) показывает, что постоянная Ридберга для изотопов водорода (дейтерия с Мд = 2Мp и трития МТ = 3Мp), вследствие различия в приведённых массах, отличается от постоянной Ридберга Rp для легкого водорода. Это хорошо согласуется с наблюдаемым сдвигом линий в спектрах дейтерия и трития по сравнению со спектром водорода (изотопический сдвиг). Теория Бора была весьма крупным шагом в развитии теории атома. Она с полной отчетливостью показала неприменимость классической физики к внутриатомным явлениям и главенствующее значение квантовых законов в микромире. Изложенная выше элементарная теория была в течение последующего десятилетия подвергнута дальнейшему развитию. Для описания более тонких эффектов, например расщепления спектральных линий, излучаемых атомами во внешнем поле, недостаточно рассмотрения только круговых орбит. Более общие условия стационарности, чем (1), пригодные для эллиптических орбит, были даны Зоммерфельдом в следующем виде: если механическая система с i-ми степенями свободы описывается обобщенными координатами qi и соответствующими обобщенными импульсами pi = ¶T/¶qi, то стационарны только те состояния системы, для которых
где ni - целые квантовые числа, а интегрирование распространяется на всю область изменения qi. В случае эллипса, описываемого полярными координатами r и j, имеем
где nj и nr - азимутальное и радиальное квантовые числа. В силу постоянства момента количества движения pj = const = p, условие (9) дает, как и в предыдущем случае круговой орбиты
Соответствующий расчет показывает, что энергия электрона зависит от суммы nj + nr = n по формуле (4). n называют главным квантовым числом. Так как nj = 1, 2, ...n, при заданном n, имеется n эллиптических орбит с одинаковой энергией (4) и с различной величиной момента количества движения (11). Если рассмотреть третью степень свободы, то условие квантования (8) для неё приводит к тому, что каждая орбита может быть сориентирована в пространстве не произвольным образом, а лишь так, что проекция момента количества движения на любое фиксированное направление OZ может принимать 2n + 1 значений, кратных h/(2p) :
m = - nj , - nj + 1 , . . . . . nj - 1, nj . (13) Теория Бора-Зоммерфельда с полной отчетливостью показала неприменимость классической физики и первенствующее значение квантовых законов для микроскопических систем. Она объяснила основные закономерности в спектрах водородоподобных ионов, щелочных металлов, рентгеновских спектрах. В её рамках впервые получили объяснения закономерности периодической системы элементов. С другой стороны, теория не дала последовательного объяснения интенсивности и поляризации спектральных линий. Никак не удались попытки построить теорию простейшей двухэлектронной системы – атома гелия. Недостатки теории Бора являются следствием её внутренней противоречивости. Действительно, с одной стороны, она привлекает чуждые классической физике идеи квантования, а с другой – пользуется для описания стационарных состояний классической механикой. Наиболее правильную картину внутриатомных физических явлений дала последовательная квантовая теория – квантовая механика, по отношению к которой теория Бора явилась важнейшим переходным этапом.
Лекция 9
1. Гипотеза де-Бройля. Волновые свойства вещества
Недостаточность теории Бора сделала необходимым критический пересмотр основ представлений о природе элементарных частиц (электронов, протонов и т. п.). Возник вопрос о том, насколько исчерпывающим является представление электрона в виде малой механической частицы, характеризуемой определенными координатами и определенной скоростью. В результате углубления наших знаний о природе света выяснилось, что в оптических явлениях обнаруживается своеобразный дуализм. Наряду с такими свойствами света, которые самым непосредственным образом свидетельствуют о его волновой природе (интерференция, дифракция), имеются и другие свойства, столь же непосредственно обнаруживающие его корпускулярную природу (фотоэффект, явление Комптона). В 1924 г. Лун де-Бройль выдвинул смелую гипотезу, что дуализм не является особенностью одних только оптических явлений, но имеет универсальное проявление. Допуская, что частицы вещества наряду с корпускулярными свойствами имеют также и волновые, де-Бройль перенес на случай частиц вещества те же правила перехода от одной картины к другой, какие справедливы в случае света. Фотон, как известно, обладает энергией
Гипотеза де-Бройля вскоре была блестяще подтверждена экспериментально. Дэвиссон и Джермер исследовали в 1927 г. отражение электронов от монокристалла никеля, принадлежащего к кубической системе. Узкий пучок моноэнергетических электронов направлялся на поверхность монокристалла, сошлифованную перпендикулярно к большой диагонали кристаллической ячейки. Отраженные электроны улавливались цилиндрическим электродом, присоединенным к гальванометру (рис. 1). Интенсивность отраженного пучка оценивалась по силе тока, текущего через гальванометр. Варьировались скорость электронов и угол j, под которым устанавливался цилиндрический электрод. На рис. 2 показана зависимость силы тока, измеряемой гальванометром, от угла j при различных энергиях электронов. Вертикальная ось на графиках определяет направление падающего пучка. Сила тока в заданном направлении представляется длиной отрезка, проведенного от начала координат до пересечения с кривой. Из рисунка видно, что рассеяние оказалось особенно интенсивным при определенном значении угла j. Этот угол соответствовал отражению от атомных плоскостей, расстояние между которыми d было известно из рентгенографических исследований. При данном j сила тока оказалась особенно значительной при ускоряющем напряжении, равном 54 В. Вычисленная по формуле (1) длина волны, отвечающая этому напряжению равнялась 1,67 ангстрема. Длина волны, соответствующая дифракционному максимуму определенному в соответствии с формулой 2d sin j = nl, равнялась 1,65 ангстрема, что можно было считать первым подтверждением гипотезы де-Бройля.
Томсон и независимо от него Тартаковскнй получили дифракционную картину при прохождении электронного пучка через металлическую фольгу. Схема опыта приведена на рис. 3. Пучок электронов, ускоренных разностью потенциалов порядка нескольких десятков киловольт, проходил через тонкую металлическую фольгу и попадал на фотопластинку. Электрон при ударе о фотопластинку оказывает на нее такое же действие, как и фотон. Полученная таким способом электронограмма золота (рис. 4, а)сопоставлена с полученной в аналогичных условиях рентгенограммой алюминия (рис. 4, б). Сходство обеих картин поразительно.
Штерн и его сотрудники показали также, что дифракционные явления обнаруживаются также у атомных и молекулярных пучков. Причем во всех этих случаях картина соответствует длине волны, определяемой формулой (1). Таким образом? из описанных опытов естественно следовало, что пучок микрочастиц определенной скорости и направления дает дифракционную картину, подобную картине, получаемой от плоской волны.
Уравнение Шредингера
Обнаружение волновых свойств микрочастиц делало необходимым создание новой механики, которая бы могла описать данные свойства. Эта механика получила название квантовой. Основным уравнением квантовой механики является уравнение Шредингера:
которое нельзя вывести из каких-либо известных ранее соотношений, аналогично второму закону Ньютона в классической механике. Его следует рассматривать как исходное основное предположение, справедливость которого доказывается тем обстоятельством, что все вытекающие из него следствия самым точным образом согласуются с опытными фактами. Состояние микрочастицы в этом уравнении описывается так называемой волновой функцией Y(x, y, z, t) – пси функцией, которая может быть найдена путем решения данного уравнения. Остальные величины, входящие в эго уравнение, имеют следующие значения: i – мнимая единица; Как следует из уравнения (2), вид волновой функции Y определяется потенциальной энергией U, т. е., в конечном счете, характером тех сил, которые действуют на частицу. В общем случае, U есть функция координат и времени. Для стационарного силового поля U волновая функция Y распадается на два множителя, одни из которых зависит только от времени, а второй – только от координат:
где Е – полная энергия частицы. В самом деле, подстановка функции (3) в уравнение (2) дает:
Сокращая все члены этого уравнения на общий множитель
Уравнение (4) называется уравнением Шредингера для стационарных состояний. В дальнейшем мы будем называть его просто уравнение Шредингера. К уравнению Шредингера можно прийти путем следующих рассуждений. Из опытов по дифракции микрочастиц вытекает, что параллельный пучок частиц обладает свойствами плоской волны, распространяющейся в направлении движения частиц. Уравнение плоской волны, распространяющейся в направлении оси х имеет, как известно, записывается
подразумевая, что надо принимать во внимание вещественную часть этого выражения. Согласно гипотезе де-Бройля свободному движению частицы соответствует плоская волна с частотой
Чтобы найти дифференциальное уравнение, которому удовлетворяет фуикция (6), воспользуемся соотношением между Е и р: Е = 2р2/m. Продифференцировав функцию (6) один раз по t a второй раз дважды по х,получим:
Из этих соотношений можно выразить Е и р2 через функцию
Подставляя последние выражения в соотношение Е = 2р2/m получим дифференциальное уравнение:
В общем случае, если направление волны не совпадает с осью х фаза колебаний будет зависеть от всех координат: х, у и z и уравнение будет совпадать с уравнением Шредингера (4) для случая U = 0 (частица по условию свободна):
Таким образом, мы получили уравнение Шредингера для свободно движущейся частицы. Теперь следует обобщить уравнение (7) на случай частицы, движущейся в потенциальном поле сил, когда полная энергия Е слагается из кинетической энергии Т и потенциальной энергии U: E = T + U. Произведя такую замену, мы придем к уравнению (4). Необходимо, однако, подчеркнуть, что приведенные рассуждения не могут рассматриваться как вывод уравнения Шредингера. Их цель – пояснить, каким образом можно было прийти к установлению вида волнового уравнения для микрочастицы. Доказательством же правильности уравнения Шредингера может служить лишь согласие с опытом тех результатов, которые получаются с помощью этого уравнения.
3. Квантово-механическое описание движения микрочастиц
Соотношение между волновой функцией
Таким образом, физический смысл функции Из сказанного вытекает, что квантовая механика имеет статистический характер. Она не позволяет определить местонахождение частицы в пространстве или траекторию, по которой движется частица. С помощью волновой функции можно лишь предсказать, с какой вероятностью частица может быть обнаружена в различных точках пространства. На первый взгляд может показаться, что квантовая механика дает менее точное описание движения частицы, чем классическая механика, которая определяет «точно» местоположение и скорость частицы в каждый момент времени. Однако в действительности это не так. Квантовая механика гораздо глубже вскрывает истинное поведение микрочастиц. Она лишь не определяет того, чего нет на самом деле. В применении к микрочастицам понятия определенного местоположения и траектории вообще теряют смысл. Движение по определенной траектории несовместимо с волновыми свойствами, что становится совершенно очевидным, если проанализировать существо опытов по дифракции. Рассмотрим дифракцию от двух близко расположенных отверстий (рис. 5). Вследствие интерференции волн, распространяющихся от отверстий, дифракционная картина не будет тождественна наложению дифракционных картин, получающихся от каждого из отверстий в отдельности (картина, получающаяся в случае рис. 5, а не совпадает с наложением картин, получающихся в случаях би в).Следовательно, вероятность попадания электрона (или какой-либо другой микрочастицы) в различные точки экрана при прохождении пучка через оба отверстия также не будет равна сумме вероятностей для случаев прохождения пучка через каждое из отверстий в отдельности. Отсюда неизбежно следует вывод, что на характер движения каждого электрона оказывают влияние оба отверстия. Такой вывод не совместим с представлением о траекториях. Если бы электрон в каждый момент времени находился в определенной точке пространства и. двигался по траектории, он проходил бы через определенное отверстие – первое иливторое. Явление же дифракции доказывает, что в прохождении каждого электрона участвуют оба отверстия: ипервое, ивторое.
Не следует, однако, представлять дело так, что какая-то часть электрона проходит через одно отверстие, а другая часть – через второе. Электрон, как и другие микрочастицы, всегда обнаруживается как целое, с присущей ему массой, зарядом и другими характерными для нею величинами. Таким образом, электрон, протон, атомное ядро представляют собой частицыс весьма своеобразными свойствами. Обычный шарик, даже и очень малых размеров (макроскопическая частица), не может служить прообразом микрочастицы. С уменьшением размеров начинают проявляться качественно новые свойства, не обнаруживающиеся у макрочастиц. В ряде случаев утверждение об отсутствии траекторий у микрочастиц, казалось бы, противоречит опытным фактам. Так, например, в камере Вильсона путь, по которому движется микрочастица, обнаруживается в виде узких следов (треков), образованных капельками тумана; движение электронов в электроннолучевой трубке превосходно рассчитывается по классическим законам, и т. п. Это кажущееся противоречие объясняется тем, что при известных условиях понятия траектории и определенного местоположения оказываются применимыми к микрочастицам, но только с некоторой степенью точности. Положение оказывается опять-таки точно таким, как и в оптике. Если размеры преград или отверстий велики по сравнению с длиной волны, распространение света происходит как бы вдоль определенных лучей (траекторий). При определенных условиях понятия положения в пространстве и траектории оказываются приближенно применимыми к движению микрочастиц, подобно тому как оказывается справедливым закон прямолинейного распространения света. Степень точности, с какой к частице может быть применено представление об определенном положении ее в пространстве, дается соотношением неопределенностей, установленным Ганзенбергом. Согласно этому соотношению частица не может иметь одновременно вполне точные значения, например, координаты х исоответствующей этой координате составляющей импульса рх, причем неопределенности в значениях этих величин удовлетворяют условию:
Такая запись означает, что произведение неопределенностей координаты и соответствующего ей импульса не может быть меньше величины порядка Соотношения, аналогичные (8), справедливы для любой координаты и соответствующего ей импульса, а также для ряда других величин, например, для взятых попарно проекций момента импульса на координатные оси. Чтобы пояснить соотношение неопределенностей, рассмотрим следующий пример. Для определения положения свободно летящей микрочастицы поставим на ее пути щель шириной Dх,расположенную перпендикулярно к направлению движения частицы (рис. 6). До прохождения частицы через щель ее составляющая импульса рх имеет точное значение, равное нулю (щель по условию перпендикулярна к скорости), так что рх = 0, зато координата х частицы является совершенно неопределенной.
В момент прохождения частицы через щель положение меняется. Вместо полной неопределенности координаты х появляется неопределенность Dх, но это достигается ценой утраты определенности значения рх. Дейтвительно, вследствие дифракции имеется некоторая вероятность того, что частица будет двигаться в пределах угла 2j, где j – угол, соответствующий первому дифракционному минимуму (максимумами высших порядков можно пренебречь, поскольку их интенсивность мала по сравнению с интенсивностью центрального максимума). Таким образом, появляется неопределенность: Ранее было установлено, что первому минимуму, получающемуся от щели шириной d,соответствует угол j, для которого Оценим неопределенность координаты и импульса для электрона в электроннолучевой трубке. Пусть след электронного пучка на экране имеет радиус порядка 10-3 см,длина трубки порядка 10 см, рис. 7. Тогда Dрх/рх~10-4.
чески неотличимо от движения по траектории. Соотношение неопределенностей отражает двойственную корпускулярно-волновую природу микрочастиц. Одного этого соотношения достаточно, чтобы получить ряд важных результатов. В частности, оно позволяет объяснить тот факт, что электрон не падает на ядро атома, а также оценить размеры простейшего атома и минимальную возможную энергию электрона в таком атоме. Если бы электрон упал на точечное ядро, его координаты и импульс приняли бы определенные (нулевые) значения, что несовместимо с принципом неопределенности. Этот принцип требует, чтобы неопределенность координаты электрона Dr и неопределенность импульса Dр были связаны условием (8). Формально энергия была бы минимальна при r = 0 и р = 0. Поэтому, производя оценку наименьшей возможной энергии, нужно положить Dr » r и Dр » р.Подставив эти значения в (8), получим соотношение Найдем значение r, при котором Е минимальна, продифференцировав и приравняв производную от энергии нулю:
Полученные нами значения совпадает с радиусом первой боровской орбиты водородного атома и энергией его основного состояния. То обстоятельство, что мы получили точные значения r и Е,является, конечно, просто удачей. Приведенный расчет может претендовать лишь на то, чтобы дать оценку порядка величины r и Е.
Поиск по сайту: |
 монохроматического света (здесь w – частота излучения;
монохроматического света (здесь w – частота излучения;  ).
).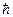 :
: , (1)
, (1) . (2)
. (2) (n = 1, 2, 3, … ) (3)
(n = 1, 2, 3, … ) (3) , т.е. величина порядка газокинетических размеров атома.
, т.е. величина порядка газокинетических размеров атома. . Из (2) следует, что
. Из (2) следует, что  Следовательно,
Следовательно,  .
. (n = 1, 2, 3, … ) (4)
(n = 1, 2, 3, … ) (4)
 . Частота испущенного кванта равна
. Частота испущенного кванта равна  .
. . (5)
. (5)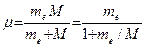 , (6)
, (6) , (7)
, (7) , (8)
, (8)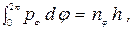 (9)
(9) , (10)
, (10) . (11)
. (11) , (12)
, (12) и импульсом
и импульсом  . По идее де-Бройля, движение электрона или какой-либо другой частицы связано с волновым процессом, длина волны которого и частота равны
. По идее де-Бройля, движение электрона или какой-либо другой частицы связано с волновым процессом, длина волны которого и частота равны и
и  . (1)
. (1)
 Рис. 2.
Рис. 2.
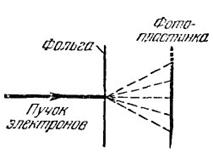 Рис. 3.
Рис. 3.
 Рис. 4.
Рис. 4.
 , (2)
, (2)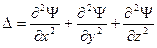 ), U – потенциальная энергия частицы.
), U – потенциальная энергия частицы. , (3)
, (3) .
. и произведя соответствующие преобразования получим дифференциальное уравнение, определяющее функцию
и произведя соответствующие преобразования получим дифференциальное уравнение, определяющее функцию 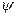 :
: (4)
(4) или в комплексном виде:
или в комплексном виде: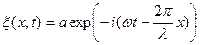 , (5)
, (5) и длиной волны
и длиной волны  . Заменяя w и р в выражении (5) энергией и импульсом частицы в соответствии с (1), получим волновую функцию для свободной частицы, движущейся в направлении оси х:
. Заменяя w и р в выражении (5) энергией и импульсом частицы в соответствии с (1), получим волновую функцию для свободной частицы, движущейся в направлении оси х: . (6)
. (6)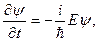


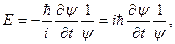

 .
. . (7)
. (7) . (8)
. (8) и, следовательно, от времени не зависит.
и, следовательно, от времени не зависит.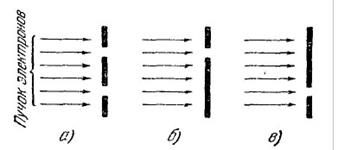
 . (8)
. (8)
 .
.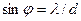 . Откуда, с учетом того, что
. Откуда, с учетом того, что  , согласующееся с (8).
, согласующееся с (8). Рис. 7
Рис. 7
 . При напряжении U ~ 104 Вэнергия электрона равна 104 эв = 1,6´ ´10-8 эрг, импульс будет р = 5 10-18 г´см/с , а Dр » 5´10-22г´см/с. Для Dх тогда получим 2 10-6 см.
Полученный результат свидетель-ствует о том, что движение электрона в рассматриваемом случае будет практи-
. При напряжении U ~ 104 Вэнергия электрона равна 104 эв = 1,6´ ´10-8 эрг, импульс будет р = 5 10-18 г´см/с , а Dр » 5´10-22г´см/с. Для Dх тогда получим 2 10-6 см.
Полученный результат свидетель-ствует о том, что движение электрона в рассматриваемом случае будет практи-
 , где для определенности вместо знака ³ мы взяли знак =. Энергия электрона в атоме водорода равна
, где для определенности вместо знака ³ мы взяли знак =. Энергия электрона в атоме водорода равна  . Подставляя сюда
. Подставляя сюда  из предыдущего соотношения получим, что
из предыдущего соотношения получим, что 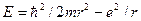 .
. , откуда следует, что
, откуда следует, что  и
и  .
.