 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Розв’язування задач на знаходження маси, об’єму, масової чи об’ємної частки компонентів суміші ⇐ ПредыдущаяСтр 10 из 10
Задача 1.Густина суміші озону і кисню за воднем дорівнює 18. Знайдіть об’ємні частки газів у суміші. Mr(суміші) = 2×18 = 36 Для газів c=j Mr(суміші) = c(О3) Mr(О3) + c(О2) Mr(О2) Нехай c(О3) = х, тоді c(О2) = 1-х 36 = 48х + 32(1-х) = 48х + 32 – 32х 4 = 16х х = c(О3) = 25%; c(О2) = 75%. Задача 2.При розчиненні в кислоті 2,33 г суміші заліза і цинку одержано 896 мл водню. Скільки г кожного з металів містилося в суміші? Розв’язок Fe + 2H+ ® Fe2+ + H2 Zn + 2 H+ ® Zn2+ + H2
m(Fe) = 56×0,03 = 1,68 г; m(Zn) = 65×0,01 = 0,65 г
Задача 3.На суміш порошків алюмінію і магнію масою 30 г подіяли надлишком соляної кислоти, а газ, що виділився, пропустили при 400°С через трубку з CuO, а потім з Р2О5. У результаті маса другої трубки збільшилась на 27 г. Визначте масову частку Алюмінію в суміші в % з точністю до цілих. Розв’язок 2Al + 6HCl = 2AlCl3 + 3H2 Mg + 2HCl = MgCl2 + H2 H2 + CuO = Cu + H2O 3H2O + P2O5 = 2H3PO4 n(H2O) = n1(Н2) = x; n(Al) = n2(H2) =y; n(Mg) = n2(H2) = y; m(Mg) = 24y;
6x = 6 x = 1; y = 0,5
Задача 4.На суміш цинк сульфіду, натрій хлориду і кальцій карбонату масою 80 г подіяли надлишком хлоридної кислоти. При цьому утворилася суміш газів об’ємом 13,44 л (н.у.). При взаємодії цієї газової суміші з надлишком сульфур(IV) оксиду утворилася тверда речовина масою 19,2 р. Визначте масові частки речовин у вихідній суміші. Розв’язок ZnS + 2HCl = ZnCl2 + H2S CaCO3 + 2HCl = CaCl2 + CO2+ H2O 2H2S + SO2 = 3S¯ + 2H2O n(S)= n(газової суміші) = n(СО2) = 0,6 – 0,4 = 0,2 n(ZnS) = n(H2S) = 0,4 m(ZnS) = 97×0,4 = 38,8 n(CO2) = n(CaCO3) = 0,2 m(CaCO3) = 0,2×100 = 20 г m(NaCl) = 80 – 38,8 – 20 = 21,2 г W(ZnS) = W(CaCO3) = W(NaCl) = Задача 5.При прожарюванні суміші, що містить однакову кількість молів сульфату, нітрату і карбонату двохвалентного металу, маса суміші зменшилась на 46,6 г. Визначте формули трьох указаних солей і їх маси в суміші, якщо суміш не містить домішок, а вміст у ній металу (як елемента) становить 30% за масою. Розв’язок
Ar(Me) = a
Me - Ca
m(CO2) = 44x ; m(O2) = 32x 32x + 44x = 46,6 x = 0,613 m(CaSO4) = 0,613×136 = 83,4 г m(Ca(NO3)2) = 0,613×164 = 100,5 г m(CaCO3) = 0,613×100 = 61,3 г Задача 6.На суміш цинк сульфіду, натрій хлориду і кальцій карбонату масою 80 г подіяли надлишком хлоридної кислоти. При цьому утворилася суміш газів об’ємом 13,44 л (н.у.). При взаємодії цієї газової суміші з надлишком сульфур(IV) оксиду утворилася тверда речовина масою 19,2 р. Визначте масові частки речовин у вихідній суміші. Розв’язок ZnS + 2HCl = ZnCl2 + H2S CaCO3 + 2HCl = CaCl2 + CO2+ H2O 2H2S + SO2 = 3S¯ + 2H2O n(S)= n(газової суміші) = n(СО2) = 0,6 – 0,4 = 0,2 n(ZnS) = n(H2S) = 0,4 m(ZnS) = 97×0,4 = 38,8 n(CO2) = n(CaCO3) = 0,2 m(CaCO3) = 0,2×100 = 20 г m(NaCl) = 80 – 38,8 – 20 = 21,2 г W(ZnS) = W(CaCO3) = W(NaCl) = Задача 7.Суміш двохвалентного металу і його карбонату масою 8,0 г розчинили в надлишку соляної (хлоридної) кислоти. У результаті взаємодії виділилось 1725 мл газу (н.у.), при пропусканні якого через вапняну воду випало 5,0 г осаду. Визначте метал і склад суміші в процентах за масою. Розв’язок Me + 2HCl = MeCl2 + H2 MeCO3 + 2HCl = MeCl2 + H2O + CO2 CO2 + Ca(OH)2 = CaCO3 + H2O n(CaCO3) = n(газу) = n(Н2) = 0,077-0,05=0,027 = n(Ме) Аr(Me) = a 0,027a + 0,05(a+60) = 8 0,077a = 5 a = 65 – Zn
Задача 8.При прожарюванні суміші калій нітрату з нітратом металу (ступінь окиснення +2, у ряді напруг знаходиться між Mg і Сu) утворилося 6,72 г твердого залишку і виділилася суміш газів загальним об’ємом 1,792 л (н.у.) і загальною масою 3,12 г. Встановіть будову нітрату, що входив до складу суміші. Розв’язок 2KNO3 ® 2KNO2 + O2 2Me(NO3)2 ® 2MeO + 4NO2 + O2 n1(O2) = x; n(KNO3) + n(KNO2) = 2x n2(O2) = y; n(Me(NO3)2) = n(MeO) = 2y; n(NO2) = 4y n(газу) =
56у = 0,56 у = 0,01 х = 0,03 m(KNO2) = 0,06×85 = 5,1 m(MeO) = 6,72-5,1 = 1,62 M(MeO) = Ar(Me) = 81 – 16 = 65 (Zn) Задача 9.Для нейтралізації суміші мурашиної та оцтової кислот масою 8,3 г витратили розчин з масовою часткою гідроксиду натрію 15% масою 40 г. Чому дорівнює масова частка оцтової кислоти в суміші кислот? Розв’язок СН3СOOH + NaOH ® CH3COONa + H2O НСOOH + NaOH ® HCOONa + H2O n(NaOH) =
14y = 0,7 y = 0,05; x = 0,1 m(CH3COOH) = 0,1×60 = 6 W(CH3COOH) =
Задача 10.Суміш етену і пропену об’ємом 11,2 л має густину за воднем 16,8. До суміші додали такий же об’єм водню і пропустили її над платиновим каталізатором. Об’єм суміші на виході з реактора склав 17,92 л. Визначте склад початкової і кінцевої суміші газів (в % за об’ємом) і ступінь перетворення (в %), вважаючи, що вона однакова для обох алкенів. Всі об’єми зміряні при н.у. Розв’язок Визначимо склад початкової суміші. Нехай х – мольна частка етену. Тоді 28х + 42(1 - х) = 16,8·2, 14х = 8,4 х = 0,6. Всього суміш містить 0,5 моль газів. Тобто її склад 0,3 моль етену і 0,2 моль пропену. Водню також 0,5 моль. Загальний об’єм 22,4 л. C2H4 + H2 → C2H6 C3H6 + H2 → C3H8 За реакцією видно, що об’єм суміші зменшується на об’єм водню, який вступив у реакцію. Кінцевий об’єм відповідає 0,8 моль (17,92 : 22,4). Значить, в реакцію вступило 0,2 моль водню. Це відповідає 40% його загальної кількості. Вуглеводнів також прореагувало в сумі 0,2 моль, що склало 40% їхньої загальної кількості. Оскільки ступені перетворення алкенів за умовою однакові, то ступінь перетворення кожного з них складає 40%. Визначимо склад кінцевої суміші. H2 - 0,3 моль C2H6 - 0,3 · 0,4 = 0,12 моль C2H4 - 0,3 · 0,12 = 0,18 моль C3H8 - 0,2 · 0,4 = 0,08 моль. C3H6 - 0,2 · 0,08 = 0,12 моль. Задача 11.Спалили 11,2 л (н.у.) пропан-бутанової суміші (ДН2= 26,2). Утворений вуглекислий газ пропустили через надлишок розчину їдкого натру, в результаті чого утворилося 1200 г розчину соди. Визначити масову частку солі в утвореному розчині. Розв’язок n(сум.) = Mr(сум.) = 26,2×2 = 52,4 c(С3Н8) = х c(С4Н10) = 1 – х Mr = c(С3Н8)×Mr(С3Н8) + c(С4Н10)×Mr(С4Н10) 52,4 = 44x + 58(1-x) 5,6 = 14x x= c(С4Н10) = 1 – 0,4 = 0,6 n(С3Н8) = 0,4×0,5 = 0,2 моль n(С4Н10) = 0,6×0,5 = 0,3 моль С3Н8 + 5О2 = 3СО2 + 4Н2О С4Н10 + 6,5О2 = 4СО2 + 5Н2О n1(СО2) = 3n (С3Н8) = 0,6 моль n2(СО2) = 4n (С4Н10) = 1,2 моль n(СО2) = 1,8 моль СО2 + 2KOH = K2CO3 + H2O n(K2CO3) = n(СО2) = 1,8 моль m(K2CO3) = 1,8×138 = 248,4 г W(K2CO3) = Задача 12.Суміш купрум(ІІ) хлориду й алюміній хлориду масою 1,646 г розчинили у воді і додали до отриманого розчину надлишок розчину калій гідроксиду. Осад, що випав, відфільтрували, промили і прожарили. Маса твердого залишку після прожарювання дорівнювала 0,8 г. Визначити масові частки солей у суміші. Розв’язок CuCl2 + 2KOH = Cu(OH)2↓ + 2KCl (1) AlCl3 + 3KOH = Al(OH)3↓ + 3KCl (2) Al(OH)3 + KOH = K[Al(OH)4] (3) Cu(OH)2 = CuO + H2O (4) Із рівнянь (1) і (4) виходить, що n(CuCl2) = n(CuO). n(CuO) = 0,8 г / 80 г/моль = 0,01 моль. m(CuCl2) = 135 г/моль × 0,01 моль = 1,35 г. ω(CuCl2) = 1,35 г / 1,646 г = 0,82 или 82%. ω(AlCl3) = 100% – 82% = 18%. Задача 13.У замкнутій посудині змішали водень, кисень і хлор. Густина отриманої газової суміші за азотом становить 0,4625. Відомо, що в суміші міститься в 14 раз більше водню, ніж хлору за об’ємом. Суміш газів зірвали і охолодили. Визначте масову частку кислоти в розчині, який виявили в посудині. Розв’язок c(Cl2) = x; c(H2) = 14x; c(O2) = 1 – (x + 14x) = 1-15x Mr(суміші) = 0,4625×28 = 12,95 Mr(суміші) = c(Cl2)×Mr(Cl2) + c(H2)×Mr×(H2) + c(O2)×Mr×(O2) 12,95 = 71x + 2×14x + 32(1-15x) 381x = 19,05 x = 0,05 = j(Cl2), бо для газів c = j j(Н2) = 0,7; j(О2) = 0,25 Приймемо об’єм газової суміші за 1 моль, тоді n(Cl2) = 0,05 моль; n(Н2) = 0,7 моль; n(О2) = 0,25 моль; 2Н2 + О2 = 2Н2О n(H2O) = 2n(O2) = 0,5 моль; m(H2O) = n×M = 0,5×18 = 9 г Н2 + Сl2 = 2НCl n(HCl) = 2n(Cl2) = 0,1 моль; m(HCl) = n×M = 0,1×36,5 = 3,65 г m(р-ну) = m(H2O) + m(HCl) = 9 + 3,65 = 12,65
Задача 14.При пропусканні 11,2 л суміші метану, карбон(IV) оксиду і карбон(ІІ) оксиду через розчин натрій гідроксиду, взятий у надлишку, об’єм вихідної суміші зменшився на 4,48 л. Для повного згоряння суміші, що залишилася, необхідно 6,72 л кисню. Визначте склад вихідної суміші (в % за об’ємом), якщо об’єми газів виміряні за однакових умов. Розв’язок 2NaOH + CO2 = Na2CO3 + H2O З натрій гідроксидом реагуватиме лише карбон(IV) оксид. Отже: V(CO2) = 4,48 л; V(CH4) + V(CО) = 11,2 – 4,48 = 6,72 л
CH4 + 2O2 = CO2 + 2H2O (1) 2CO + O2 = 2CO2 (2) Нехай V(CH4) = x, тоді V1(О2) = 2x (за рівнянням 1)
 Нехай V(CО) = y, тоді V2(О2) = 0,5y (за рівнянням 2) Нехай V(CО) = y, тоді V2(О2) = 0,5y (за рівнянням 2)
1,5y = 6,72 y = 4,48 x = 2,24
Поиск по сайту: |

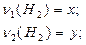

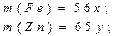
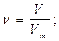
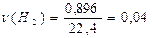 моль
моль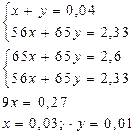
 моль = n(Н2)
моль = n(Н2)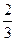 n1(H2) =
n1(H2) = 

 0,6 моль, n(H2S)=
0,6 моль, n(H2S)= 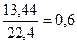

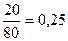

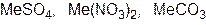
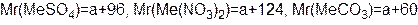

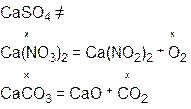
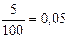 моль = n(СО2) = n( MeCO3)
моль = n(СО2) = n( MeCO3)

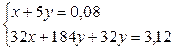



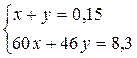
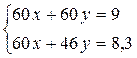
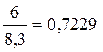
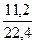 = 0,5 моль
= 0,5 моль = 0,4 - c(С3Н8)
= 0,4 - c(С3Н8) = 0,207, або 20,7%
= 0,207, або 20,7%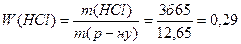 або 29%
або 29%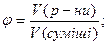
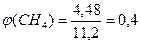 ,або 40%
,або 40%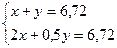 [
[ 
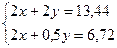 -
-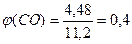 , або 40%
, або 40%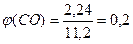 , або 20%
, або 20%