 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Швидкість хімічної реакції. Хімічна рівновага
Задача 1. Рівновага реакції 2NO + O2 D 2NO2 установилася при таких концентраціях реагуючих речовин (моль/л): С(NO)=0,5; С(О2)=0,7; С(NO2) = 2,1. Як зміняться швидкості прямої і зворотної реакції, якщо в системі зменшити загальний тиск в 2 рази? Чи відбудеться при цьому зміщення рівноваги реакції? Відповідь підтвердити розрахунками. Розв’язок 2NO + O2 ® 2NO2 Рівноважні 0,5 0,7 2,1
При зменшенні тиску в 2 рази концентрації всіх реагуючих речовин зменшаться в 2 рази. Тоді:
Отже, швидкість зворотної реакції буде в 2 рази більшою ніж прямої. Зміщення рівноваги пройде справа наліво, тобто в сторону розкладу NO2. Задача 2.Суміш карбон(ІІ) оксиду і водяної пари, що містить 50% СО і 50% Н2О (за об’ємом), пропустили при 1400 К над залізним каталізатором. Константа рівноваги реакції СО + Н2О = СО2 + Н2 дорівнює 0,5. Обчислити вихід продуктів і процентний (за об’ємом) склад рівноважної газової суміші. Розв’язок СО + Н2О = СО2 + Н2 Вихідні 1 1 – – В реакції x x x x Рівноважні (1-x) (1-x) x x
Задача 3. Для реакції N2 + O2 ® 2NO при 2400°С Кр= 0,0035 розрахуйте склад суміші у стані рівноваги в об’ємних %, якщо вихідна суміш містить рівну кількість N2 та О2. Розв’язок
Вихідні 1 1 - В реакції х х 2х Рівноважні (1-х) (1-х) 2х
Рівноважні концентрації відповідно становлять: [N2]=0,9792; [O2]=0,9792; [NO] = 0,0416 Для газів c = j. Задача 4.У посудині об’ємом 10 л при 400°С змішали 2 г водню і 80 г брому. Знайшли, що в стані рівноваги 20% брому перетворюється в бромоводень. Скільки бромоводню буде міститися в рівноважній суміші, якщо зменшити вихідну кількість брому в 2 рази? Розв’язок C(H2) = H2 + Br2 D 2HBr Вихідні 0,1 0,05 - В реакції 0,01 0,01 0,02 Рівноважні 0,09 0,04 0,02 Kp = H2 + Br2 D 2HBr Вихідні 0,1 0,025 - В реакції x x 2x Рівноважні (0,1-x) (0,025-x) 2x Kp = 4x2 = 0,0002775 – 0,0111x – 0,002775x + 0,111x2 3,889x2 + 0,013875x – 0,00027,75 = 0 x = x = 0,00685 [HBr] = 2·0,00685 = 0,0137 Задача 5.Хімічна рівновага реакції CO2 + H2 D CO + H2O установилась при таких концентраціях реагуючих речовин (моль/л): С(СО2) = 7; С(Н2) = 5; С(СО) = 10; С(Н2О) = 14. Рівновага системи була порушена через зменшення концентрації Н2О до 11 моль/л. Обчисліть, якими стали нові рівноважні концентрації реагуючих речовин після зміщення рівноваги? Розв’язок СO2 + H2 D CO + H2O Рівноважні 7 5 10 14 Kp = СO2 + H2 D CO + H2O Рівноважні 7-x 5-x 10+x 11+x Kp = 110 + 10x + 11x + x2 = 140 – 28x – 20x + 4x2 3x2 - 69x + 30 = 0 x2 – 23x + 10 = 0
x = 0,44 [CO2] = 6,56; [H2] = 4,56; [CO] = 10,44; [H2O] = 11,44 Задача 6.Хімічна рівновага реакції СOCl2 D CO + Cl2 установилась при концентра-ціях реагуючих речовин (моль/л): С(COCl2) = 10; C(CO) = 2; C(Cl2) = 4. У рівноважну систему додали хлор в кількості 4 моль/л. Визначте нові рівноважні концентрації реагуючих речовин після зміщення рівноваги. Розв’язок СOCl2 D CO + Cl2 Рівноважні 10 2 4 Kp = СOCl2 D CO + Cl2 Рівноважні 10+x 2-x 8-x Kp = 16 –2x – 8x + x2 = 8 + 0,8x x2 – 10,8x + 8 = 0
x = 0,8 Задача 7.Об’ємний склад реакційної суміші в момент рівноваги для реакції 2СО2 D 2СО + О2 був таким: 88,72% СО2; 7,52% СО; 3,76% О2. Знайдіть Кр і Кс для цієї реакції, якщо загальний тиск в системі при даній температурі (2273 К) дорівнює 1,0133·105 Па. Розв’язок 2СО2 ® 2СО + О2 р(СО2) = 1,013×105×0,852 = 0,863×105 Па р(СО) = 1,013×105×0,099 = 0,100×105 Па р(О2) = 1,013×105×0,049 = 0,050×105 Па
Dn – різниця між числом моль газоподібних продуктів реакції та газоподібних вихідних речовин. 2-й спосіб.
Поиск по сайту: |
 прямої р-ції = k1[NO]2[O2]
прямої р-ції = k1[NO]2[O2]


 = 0,293, або 29,3%
= 0,293, або 29,3% = 0,207, або 20,7%
= 0,207, або 20,7%



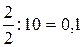 ; C(Br2) =
; C(Br2) = 

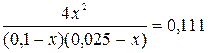




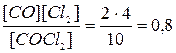


 Па
Па
