 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Обчислення за рівнянням хімічної реакції
Задача 1.Суміш хлорату і нітрату калію масою 6,49 г з каталітичною добавкою марган(IV) оксиду нагріли до повного припинення виділення газу. Цей газ пропустили через трубку з нагрітою міддю. Речовину, що утворилася, обробили 53,1 мл 19,6%-ного розчину сульфатної кислоти (r=1,13 г/мл). Для нейтралізації кислоти, що залишилася, необхідно 25 мл розчину натрій гідроксиду з концентрацією 1,6 моль/л. Визначити масові частки солей в суміші і об’єм газу (н.у.), який виділився при нагріванні. Розв’язок 2KClO3 ® 2KCl + 3O2 (1) 2KNO3 ® 2KNO2 + O2 (2) 2Cu + O2 ® 2CuO (3) CuO + H2SO4 ® CuSO4 + H2O (4) H2SO4 + 2KOH ® K2SO4 + 2H2O (5) n(KOH) = C×V = 1,6×0,025 = 0,04 моль За рівнянням (5): n1(H2SO4) = Всього в розчині сульфатної кислоти було: n(H2SO4) = Отже, на реакцію (4) витрачено: n2(H2SO4) = 0,12 - 0,02 = 0,1 моль За рівнянням (4): n(CuO) = n2(H2SO4) = 0,1 моль, а за рівнянням (3): n(О2) = Приймемо: n1(О2) = х, кисень, що утворився в реакції (1); n(KClO3) = n2(O2) = y, кисень, що утворився в реакції (2); n(KNO3) = 2n2(O2) = 2y; m(KNO3) = 101×2y = 202y
202x + 202y = 10,1
x = 0,03; y = 0,02 W(KClO3) = Задача 2.У склянці без етикетки знаходиться біла, добре розчинна у воді речовина. При дії на розчин цієї речовини водним розчином натрій гідроксиду виділяється газ з різким запахом. До розчину, що містить 4,9 г вихідної речовини, додали надлишок розчину аргентум(І) нітрату. Осад, що випав, відфільтрували, промили та висушили, його маса становила 9,4 г. Яка речовина була в склянці? Якщо при дії лугу виділяється газ з різким запахом, то невідома речовина – сіль амонію. (NH4)xA + xAg(NO3)2 = xNH4NO3 + AgxA¯ Оскільки всі нітрати розчинні у воді, в осад випадає AgxA. Нехай відносна атомна маса Ar(А) = а Mr((NH4)xA) = 18x + a Mr(AgxA) = 108x+a n((NH4)xA) = За рівнянням реакції n((NH4)xA) = n(AgxA)
529,2х + 4,9а = 169,2х +9,4а 360х = 4,5а; а =
Невідома сіль – амоній бромід NH4Br Задача 3.Визначити масу оцтової кислоти, одержаної з спирту, який у свою чергу був добутий бродінням 200 кг технічної глюкози, масова частка нецукристих домішок у якій становить 10%. Розв’язок C6H12O6 ® 2C2H5OH + 2CO2
n(C6H12O6) = n(cп.) = 2 моль = n(к-ти) m(к-ти) = 60×2 = 120 кг
Задача 4.44 г суміші органічних речовин одного і того ж складу С4Н8О2 обробили карбонатом натрію, при цьому виділився оксид вуглецю (IV) і утворилося 22 г натрієвої солі органічної кислоти. Залишок обробили водним розчином лугу при нагріванні і здійснили відгонку утвореного при цьому етилового спирту. Установити будову речовин у вихідній суміші. Обчислити, яку масу етанолу одержали. Розв’язок 2C3H7COOH + Na2CO3 ® 2C3H7COONa + CO2 + H2O CH3COOC2H5 + NaOH ® CH3COONa + C2H5OH n(C3H7COONa) = m(к-ти) = 0,2×88 = 17,6 m(ефіру) = 44-17,6 = 26,4 n(ефіру) = m(спирту) = 0,3×46 = 13,8 Задача 5.До 342 г 10%-ного розчину гідроксиду металу другої групи додали надлишок розчину карбонату натрію. При цьому випав осад масою 39,4 г. Осад відфільтрували та, перемішуючи, розчинили в 46,5 мл 20%-ної хлоридної кислоти (r = 1,1). Який газ і в якому об’ємі (н.у.) при цьому виділився? Розв’язок Ме(OH)2 + Na2CO3 = MeCO3¯ + 2 NaOH MeCO3 + 2HCl = MeCl2 + CO2 + H2O Ar(Me) = x; Mr(Me(OH)2) = x + 34; Mr(MeCO3) = x + 60 n(Me(OH)2) = n(MeCO3)
x = 137 (Ba) n(BaCO3) = n(HCl) = n(СО2) = Задача 6.Суміш порошків заліза та сірки нагріли без доступу повітря. На одержані продукти подіяли хлоридною кислотою, в результаті чого утворилося 6,72 л газів. При повному їх згорянні утворилося 0,2 моль газу. Об’єми всіх газів приведені до нормальних умов. Визначте склад вихідної суміші. Розв’язок Fe + S = FeS; FeS + 2HCl = FeCl2 + H2S Fe + 2HCl = FeCl2 + H2 2H2S + 3O2 = 2SO2 + 2H2O 2H2 + O2 = 2H2O 0,2 моль газу, що залишився після згоряння – це SO2 n(H2S) = n(SO2) = n(FeS) = n1(Fe) = 0,2 моль При дії HCl виділився газ кількістю речовини:
n(Н2) = 0,3–0,2 = 0,1 моль = n2(Fe); n(Fe) = 0,2 + 0,1 = 0,3 моль n(S) = n(FeS) = 0,2 моль
Задача 7.У атмосфері кисню спалили 6 г деякої речовини Y. Одержану при згорянні речовину кількісно поглинули 38,57 мл 37%-вого розчину їдкого натру (r = 1,40). Масова частка лугу в утвореному розчині зменшилася у 2 рази в порівнянні з початковою, причому, утворений розчин може хімічно зв’язати 11,2 л вуглекислого газу (умови нормальні). Яку речовину спалили? m(р-ну) = 38,57×1,4 » 54 г m(NaOH) = 54×0,37 »20 n(NaOH) = 2NaOH + CO2 = Na2CO3 + H2O n(CO2) = Отже, маса NaOH у розчині не змінилася. Тоді змінилася маса розчину. Речовина Y може бути водень. 2H2 + O2 = 2H2O n(H2) = m(H2O) = 3×18 = 54 г Маса розчину збільшилась у 2 рази, отже, масова частка лугу зменшилась у 2 рази: W¢(NaOH) =
Задачі на надлишок Задача 1. Який об’єм водню, виміряний за н.у., виділиться при дії на алюміній масою 32,4 г розчину об’ємом 200 мл з масовою часткою гідроксиду калію 30% і густиною 1,29 г/мл? 2Al + 2KOH + 6H2O = 2K[Al(OH)4] + 3H2 Якщо дано маси двох вихідних речовин, то шукаємо, яка з речовин у недостачі і по ній ведемо розрахунок. n = n(Al) = n = n = n(KOH) = За рівнянням реакції кількості речовин співвідносяться між собою 1:1. Отже, КОН у надлишку. Розрахунок ведемо за кількістю речовини алюмінію. n(Н2) = V = n×Vm V(H2) = 1,8 моль × 22,4 л/моль = 40,32 л Задача 2. Унаслідок реакції між залізом масою 22,4 г та хлором, об’ємом 15,68 л (н.у.), добули ферум(III) хлорид, який розчинили у воді масою 500 г. Визначити масову частку ферум(III) хлориду в добутому розчині. 2Fe + 3Cl2 =2FeCl3 Якщо дано маси двох вихідних речовин, то шукаємо, яка з речовин у недостачі і по ній ведемо розрахунок. n = n(Fe) = n = n(Cl2) = За рівнянням реакції залізо і хлор реагують у мольному співвідношенні 2:3, отже, хлор у надлишку. Розрахунок ведемо за кількістю речовини заліза n(FeCl3) = n(Fe) = 0,4 моль m = n×M m(FeCl3) = 0,4 моль × 162,5 г/моль = 65 г Знайдемо масу розчину: m(р-ну) = m(Н2О) + m(FeCl3) m(р-ну) = 500 г + 65 г = 565 г W = W(FeCl3) = Задача 3.Яка маса осаду утвориться, якщо пропустити оксид вуглецю (IV) об’ємом 218 мл (н.у.) крізь розчин масою 20 г з масовою часткою гідроксиду барію 0,12? Розв’язок CO2 + Ba(OH)2 = BaCO3 + H2O (1) V = n(CO2) = n = n = n(Ba(OH)2) = У недостачі барій гідроксид, тому розрахунки ведемо за кількістю речовини барій гідроксиду n(BaCO3) = n(Ba(OH)2) = 0,012 моль Осад барій карбонату реагує з надлишком вуглекислого газу з утворенням розчинної кислої солі BaCO3 + CO2 + H2O = Ba(HCO3)2 (2) За рівнянням (1) на 0,012 моль барій гідроксиду витратиться 0,012 моль карбон(IV) оксиду n1(СО2) = n(Ba(OH)2) = 0,012 моль На взаємодію з барій карбонатом витратиться: n2(СО2) = 0,014 моль – 0,012 моль = 0,002 моль = n1(BaCO3) Отже, кількість речовини осаду ВаСО3 становитиме: n¢( BaCO3) = n(BaCO3) – n1(BaCO3) n¢( BaCO3) = 0,012 моль – 0,002 моль = 0,01 моль m = n×M m¢(BaCO3) = 0,01 моль × 197 г/моль – 1,97 г Задача 4.Через 200 г розчину амоній дигідрогенфосфату з масовою часткою солі 23% пропущено газ, який одержали взаємодією 10,7 г амоній хлориду надлишком калій гідроксиду. Які речовини і якої маси залишаться в розчині після його випарювання при помірній температурі? Розв’язок NH4Cl + KOH = KCl + NH3 + H2O (1) NH4H2PO4 + NH3 = (NH4)2HPO4 (2) n = n(NH4Cl) = За рівнянням реакції (1) n(NH3) = n(NH4Cl) = 0,2 моль n = n = n(NH4H2PO4) = За рівнянням реакції (2) речовини реагують між собою у мольному співвідношенні 1:1 n(NH4H2PO4) = n(NH3) = n(NH4)2HPO4) = 0,2 моль Отже, у розчині після закінчення реакції залишиться 0,2 моль амоній гідрогенфосфату і 0,4 моль – 0,2 моль = 0,2 моль амоній дигідрогенфосфату. m = n×M m((NH4)2HPO4) = 0,2 моль × 132 г/моль = 26,4 г m(NH4H2PO4) = 0,2 моль × 115 г/моль = 23 г
Задача 5.Крізь 500 г 17%-ного розчину нітрату срібла пропустили газ, що утворився при дії концентрованої сірчаної кислоти (V=200 мл, W = 98%, r=1,21) на безводний хлорид магнію масою 114 г. Визначити процентну концентрацію сполук, що залишились у розчині після відокремлення осаду. Розв’язок H2SO4 + MgCl2 = MgSO4 + HCl (1) n = n = n(H2SO4) = n(MgCl2) = У недостачі магній хлорид, розрахунки ведемо за кількістю речовини магній хлориду. n(HCl) = 2n(MgCl2) = 1,2×2 = 2,4 моль m(HCl) = 2,4 моль × 36,5 г/моль = 87,6 г AgNO3 + HCl = AgCl¯ + HNO3 (2) n(AgNO3) = За рівнянням реакції (2) кількості речовини аргентум нітрату і хлороводню відносяться 1:1. Отже, хлороводень у надлишку і розрахунок ведемо за кількістю речовини арґентум нітрату. n(AgCl) = n(AgNO3) = 0,5 моль = n(HNO3) m = n×M (AgCl) = 0,5 моль×142,5 г/моль = 71,25 г У розчині після відокремлення осаду залишаться нітратна кислота кількістю речовини 0,5 моль і надлишок HCl. n¢(HCl) = 2,4 моль – 0,5 моль = 1,9 моль m(HNO3) = 0,5 моль × 63 г/моль = 31,5 г m¢(HCl) = 1,9 моль × 36,5 г/моль = 69,35 г Маса розчину після відокремлення осаду становитиме: m¢(р-ну) = m(р-ну) + m(HCl) – m(AgCl) m¢(р-ну) = 500 г + 87,6 г – 71,25 г = 516,35 г W = W(HNO3) = W¢( HCl) = Задача 6.Наважки сульфату хром(III) сульфату і калій гідроксиду по 39,2 г кожна розчинили у воді і піддали взаємодії. Обчисліть масу осаду, що утворився після закінчення реакції. Розв’язок Cr2(SO4)3 + 6KOH = 2Cr(OH)3¯ + 3K2SO4 (1) n = n(Cr2(SO4)3) = n(KOH) = За рівнянням реакції (1) на 1 моль Cr2(SO4)3 витрачається 0,6 моль КОН, отже, КОН у надлишку. Розрахунок ведемо за кількістю речовини хром(III) сульфату. n(Cr(OH)3) = 2n(Cr2(SO4)3 = 0,2 моль Але хром(ІІІ) гідроксид проявляє амфотерні властивості і буде реагувати з надлишком калій гідроксиду. Cr(OH)3 + 3KOH = K3[Cr(OH)6] (2) За рівнянням реакції (1) з 0,1 моль хром(ІІІ) сульфату прореагує 0,6 моль калій гідроксиду. n¢(КОН) = 0,7 моль – 0,6 моль = 0,1 моль За рівнянням реакції (2): n1(Cr(OH)3) = n¢(Cr(OH)3) = 0,2 моль – 0,033 моль = 0,167 моль m¢(Cr(OH)3) = 0,167 моль × 103 г/моль = 17,2 г
Поиск по сайту: |
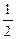 n(KOH) = 0,02 моль
n(KOH) = 0,02 моль моль
моль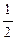 n(СuO) = 0,05 моль.
n(СuO) = 0,05 моль. n1(O2) =
n1(O2) =  x; m(KClO3) = 122,5×
x; m(KClO3) = 122,5× 
 81,67x + 202y = 6,49
81,67x + 202y = 6,49 120,33x = 3,61
120,33x = 3,61 , або 33,75%; W(KNO3) = 62,25%
, або 33,75%; W(KNO3) = 62,25%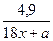 ; n(AgxA) =
; n(AgxA) = 
 = 80х
= 80х

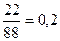
 = n(спирту)
= n(спирту) ;
; 
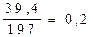 моль - надлишок
моль - надлишок моль - недостача
моль - недостача n(HCl) = 0,14 моль; V(CO2) = 0,14×22,4 = 3,136 л
n(HCl) = 0,14 моль; V(CO2) = 0,14×22,4 = 3,136 л моль
моль 

 = 0,5 моль
= 0,5 моль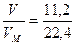 = 0,5 моль
= 0,5 моль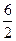 = 3 моль = n(Н2О)
= 3 моль = n(Н2О)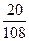 = 0,185 або 18,5%
= 0,185 або 18,5%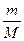
 = 1,2 моль
= 1,2 моль
 = 1,38 моль
= 1,38 моль n(Al) =
n(Al) = 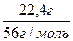 = 0,4 моль
= 0,4 моль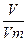
 = 0,7 моль
= 0,7 моль
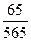 = 0,115, або 11,5%
= 0,115, або 11,5% = 0,014 моль
= 0,014 моль
 = 0,012 моль
= 0,012 моль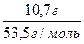 = 0,2 моль
= 0,2 моль = 0,4 моль
= 0,4 моль = 2,42 моль
= 2,42 моль = 1,2 моль
= 1,2 моль = 0,5 моль
= 0,5 моль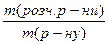
 = 0,061, або 6,1%
= 0,061, або 6,1%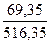 = 0,1343, або 13,43%
= 0,1343, або 13,43% = 0,1 моль
= 0,1 моль = 0,7 моль
= 0,7 моль n¢(КОН) =
n¢(КОН) =