 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Задачі на приготування розчинівСтр 1 из 10Следующая ⇒
Зразки розв’язків типових розрахункових задач Основні позначення фізичних величин та формули для їх визначення Аr – відносна атомна маса; Мr – відносна молекулярна маса; W – масова частка; j – об’ємна частка; c – мольна частка; С – молярна концентрація; т – маса речовини; m(a) – маса одиничного атома або одиничної молекули в кілограмах або грамах; h – вихід продукту реакції від теоретично можливого; r – густина; V – об'єм; n – кількість речовини; N – число структурних частинок (атомів, йонів або молекул) у даній речовині; Nа – стала Авогадро, яка дорівнює 6,022 × 1023 моль-1; М – молярна маса речовини; Vm – молярний об'єм газів; D – відносна густина газів
Обчислення за хімічною формулою Задача 1. Визначити відносну молекулярну масу сульфатної кислоти H2SO4. Розв’язок
Задача 2. Яка буде формула нітроген оксиду, у якому масова частка Оксигену складає 36,36%? Розв’язок Аr(N) = 14; Ar(O) = 16. Оскільки Оксиген у сполуках проявляє валентність ІІ, то формула нітроген оксиду:
Задача 3. Деякі елементи X i Y утворюють сполуки XYO4 (W(O) = 40,51%) i X2YO4 (W(O) = 32,49%). Визначити елементи X i Y. Розв’язок W(ел.) = Mr(XYO4) = Нехай Аr(X) = x; Ar(Y) = y. Тоді:
х = 39 (К); y =55 (Mn) KMnO4 i K2MnO4 Задача 4.Речовина має загальну формулу E2CrO4. Масова частка невідомого елемента в цій сполуці становить 40,206%. Визначити, який це елемент. Розв’язок Визначимо масову частку CrO4 у сполуці: W(CrO4) = 100% – 40,206% = 59,794% Виходячи з формули W(CrO4) = Mr(E2CrO4) = Ar(E) = Невідомий елемент – калій. Задача 5.Доведіть, що існують сполуки з загальною формулою ЕНх, які містять 12,5% Гідрогену за масою. Розв’язок W(H) = 0,125 = Ar(E) = 7x
Задача 6. Деякі галуни (кристалогідрат загальною формулою А1+Б3+(SO4)2×12H2O) містять 51,76% Оксигену і 4,53% Гідрогену. Визначте їх формулу. Розв’язок Знаючи кількість атомів Оксигену, що входять до складу кристалогідрату, визначимо його молярну масу.
Молярну масу кристалогідрату можна визначити і через Гідроген:
Різні значення відносної молекулярної маси невідомого кристалогідрату свідчать, що до складу катіона може входити Гідроген, тобто, катіон амонію. Тоді: Аr(Б) = Mr(А1+Б3+(SO4)2×12H2O) – Mr(NH4+) – 2Mr(SO4) – 12Mr(H2O) Аr(Б) = 618 – 18 – 192 – 12×18 = 192 (Ir) NH4Ir(SO4)2×12H2O Задача 7. Хімічний елемент Х широко застосовується в металургії, літакобудуванні та інших галузях промисловості. Найважливіші руди цього елемента містять його вищий солетворний оксид. Хлорид, у якому елемент проявляє валентність відповідно до його місця в періодичній системі, містить 74,74% хлору. Який це елемент? Розв’язок Нехай формула хлориду невідомого елемента EClx, де х – валентність елемента. Виходячи з формули визначення масової частки елемента в сполуці W(Cl) = Mr(EClx) = Ar(E) = 47,5x – 35,5x = 12x Оскільки х – валентність невідомого елемента, то вона може бути від 1 до 7:
Оскільки Карбон не буває одновалентним, то можливі два варіанти розв’язку: Mg (MgCl2) i Ti (TiCl4). Задача 8. Вищий оксид хімічного елемента V групи має відносну молекулярну масу 102. Назвіть хімічний елемент, складіть формули його вищого оксиду та гідрату оксиду, зазначте їх характер. Розв’язок Е2О3 Аr(E) = x 2x + 48 = 102 x = 27 (Al) Al2O3, Al(OH)3 – амфотерні Al2O3 + 2NaOH = 2NaAlO2 + H2O або Al2O3 + 2NaOH + 3 H2O = 2Na[Al(OH)4] Al(OH)3 + NaOH = NaAlO2 + 2H2O або Al(OH)3 + NaOH = Na[Al(OH)4] Задача 9. Масова частка Гідрогену в кислоті становить 1,25%. До складу кислоти входять також Фосфор(V) та Оксиген. Визначити формулу кислоти. Відповідь підтвердити розрахунками. Розв’язок HxPyOz W(P) = y1; W(O) = z1 y1 + z1 = 100 – 1,25 = 98,75% m(р-ни) = 100 г n(H) = Молекула електронейтральна, тому:
W(P) = 38,75% W(O) = 60,00% n(Н):n(Р):n(О) = 1,25: HPO3 Задача 10.Якщо до 100 г розчину сульфату натрію з масовою часткою розчиненої речовини 53% добавити тверду сіль А, то масова частка розчиненої речовини не зміниться. А якщо до одержаного розчину добавити сіль В масою, що дорівнює масі розчину, то масова частка солі зменшиться до 48,5%. Знайдіть формули та визначте маси солей А і В, якщо їх співвідношення 1:5. Розв’язок Оскільки при додаванні солі А масова частка розчиненої речовини не зміниться, то сіль А – кристалогідрат, у якому масова частка солі така ж, як і в розчині – 53%. Na2SO4∙xH2O Mr(Na2SO4∙xH2O) = x = Сіль Б – Na2SO4∙yH2O Позначимо масову частку солі Na2SO4∙у кристалогідраті Na2SO4∙yH2O через а. Для визначення масової частки натрій сульфату∙в кристалогідраті Б використаємо „правило хреста” (див. с. ??)
48,5–a = 4,5 а = 44 Знайдемо відносну молекулярну масу солі В: Mr(Na2SO4∙yH2O) = y = Нехай маса солі А: m(A) = m, тоді маса солі В: m(B) = 100 + m За умовою задачі маса солі А відноситься до маси солі В як
5m = 100+m 4m = 100 m = 25 г (m(A)) m(B) = 125 г Задача 11. Хлорпохідне насиченого вуглеводню має відносну молекулярну масу 237. Масова частка Хлору в сполуці рівна 0,899, а масова частка Карбону рівна 0,101. Знайдіть молекулярну формулу хлорпохідного. Розв’язок СхCly n(C) = C2Cl6 Задача 12. Органічна речовина А містить 41,38% С, 3,45% Н, решта – Оксиген. При нагріванні з етанолом у присутності кислоти ця речовина утворює сполуку Б, що містить 55,61% Карбону, 6,97% Гідрогену і Оксиген. При взаємодії з бромоводнем речовина А утворює продукт В, який при кип’ятінні у воді дає речовину Г, що містить 35,82% Карбону, 4,48% Гідрогену і Оксиген. 2,68 г речовини Г взаємодіє з 20 мл 2 М розчину їдкого калі. Виведіть структурні формули речовин А, Б, ВіГ. Розв’язок A: CxHyOz x : y : z = Б: CaHkOs a : k : s = Г: CmHnOg m : n : g = n(KOH) = C×V = 2 × 0,02 = 0,04 моль n(С4Н6О5) = Тоді це двохосновна оксикарбонова кислота. Її формула:
Г Тоді речовини, згадані в умові задачі, матимуть формули: А – С4Н4О4; Б – С8Н12О4; В – С4Н5О4Br. Рівняння реакцій:
Задача 13.Газ А має густину в 3 рази більшу за повітря. При взаємодії з водою газу А на холоді і в темноті одержують тільки кислоту Б, яка на світлі здатна перетворюватися в дві кислоти – В і Г. Якщо розчинити у воді газ А, пропущений попередньо через розжарену скляну трубку, одержують теж дві кислоти – Б і В. При взаємодії одного з продуктів термічного розкладу газу А з розчином лугу в залежності від умов одержують солі кислот або Б і В, або В і Г. Укажіть перелічені речовини і напишіть рівняння реакцій, якщо відомо, що одна із солей кислоти Г містить 31,8% калію і 39,2% кисню. Розв’язок Сіль кислоти Г – КхЕyOz. Молекула електронейтральна, тому:
0,815 + 29n = 4,085a 7,1n=a
Г – KxClyOz x : y : z = 0,815 : 0,816 : 2,45 = 1 : 1 : 3 KClO3 Mr(A) = 29·3 = 87 – Cl2O A – Cl2O; Б – HClO; В – HCl; Г – HClO3 Cl2O + H2O = 2HClO 2Cl2O = 2Cl2 + O2 3HClO = 2HCl + HClO3 Cl2 + H2O = HCl + HClO Cl2 + KOH 3Cl2 + 6KOH Задача 14.Речовина А з відносною молекулярною масою 94 має такий процентний склад: 76,60% С, 6,38% Н, 17,02% О (за масою). Речовина А реагує з натрієм і гідроксидом натрію. При взаємодії А з метилхлоридом в присутності АlCl3 утворюються речовини В і С, а також хлороводень. Речовина D з відносною молекулярною масою 92 має процентний склад: 91,30% С, 8,70% Н (за масою) і на світлі реагує з хлором з утворенням речовини Е, яка при гідролізі в лужному середовищі перетворюється в речовину F, ізомерну речовинам В і С. Наведіть структурні формули речовин А, В, С, D, E i F і напишіть рівняння згаданих хімічних реакцій. Розв’язок n(С) = С6Н6О. Так як речовина А взаємодіє з натрієм і натрій гідроксидом, то це фенол:
Речовина D: n(C) = Враховуючи умову задачі, речовина D – толуол.
Задачі на приготування розчинів Задача 1.Визначте масу 24,5%-ного розчину сульфатної кислоти, в якому треба розчинити 120 г сірчаного ангідриду, щоб утворився 49%-ний її розчин? Розв’язок Такі задачі можна розв’язувати через „правило хреста”. Нехай є розчин масою m1, у якому масова частка розчиненої речовини W1. До цього розчину долили розчин масою m2, у якому масова частка розчиненої речовини W2. При цьому утворився розчин масою m3, у якому масова частка розчиненої речовини W3, причому, маса утвореного розчину буде дорівнювати сумі мас першого і другого розчинів, а маса розчиненої речовини в третьому розчині буде дорівнювати сумі мас розчиненої речовини у першому і другому розчинах.
  
  
Оскільки маса розчиненої речовини в третьому розчині буде дорівнювати сумі мас розчиненої речовини у першому і другому розчині, то: W1 m1 + W2 m2 = W3 m3 Так як маса третього розчину буде дорівнювати сумі мас першого і другого розчинів, то: W1 m1 + W2 m2 = W3 (m1 + m2) W1 m1 + W2 m2 = W3 m1 + W3 m2 W1 m1 – W3 m1 = W3 m2 – W2 m2 m1(W1 – W3) = m2(W3 – W2)
Часто замість виведення формули правила змішування використовують „правило хреста”
1. І спосіб.
W1 – уявна масова частка сульфатної кислоти в сірчаному ангідриді.
0,245 0,735
ІІ спосіб. SO3 + H2O = H2SO4 m(р-ну H2SO4) = x; m(H2SO4) = 0,245x;
Задача 2.Визначити масу води, в якій треба розчинити 45 г цукру, щоб одержати розчин з масовою часткою цукру 10%. Розв’язок
Задача 3.Визначте маси розчину сульфур(VI) оксиду в чистій сульфатній кислоті (масова частка сульфур(VI) оксиду дорівнює 10%) і розчину з масовою часткою сульфатної кислоти 60%, необхідні для приготування 480 г розчину з масовою часткою сульфатної кислоти 90%. Розв’язок m (H2SO4) = 0,9×480 = 432 m(олеуму) = х m(SO3) = 0,1x; m1(H2SO4) = 0,9x; SO3 + H2O = H2SO4 n(SO3) = n2(H2SO4) = m2(p-ну) = 480 – х m3(H2SO4) = 0,6(480-х) = 288 – 0,6х 0,9х + 0,1225х + 288 – 0,6х = 432 х = 340,83 (m(олеуму) m2(p-ну) = 480 – 340,83 = 139,17 Задача 4.При розчиненні у воді масою 160 г кристалогідрату MeSO4×5H2O масою 40 г одержали розчин з масовою часткою MeSO4 12,8%. Визначте невідому сіль. Розв’язок Ar(Me) = x Mr(MeSO4) = x + 96 Mr(MeSO4×5H2O) = x + 186 Масова частка солі в кристалогідраті становить: W(MeSO4) = m(MeSO4) = W(MeSO4)×m(кристалогідрату) m(MeSO4) = Для визначення масової частки солі в розчині скористаємося формулою: W(MeSO4) = Підставимо у цю формулу всі відомі нам величини 0,128 = x = 64 (Cu) Задача 5.Скільки молекул метилового спирту (СН3ОН) і води міститься в 100 мл 12%-вого водного розчину метилового спирту, густина якого 0,98 г/см3? Розв’язок m(р-ну) = V×r; m(р-ну) = 100×0,98 = 98 г; m(CH3OH) = m(р-ну)×W = 98×0,12 = 11,76 г n = N(СН3ОН) = n×NA = 0,3675×6,02×1023 = 2,21235×1023 молекул m(H2O) = 98 – 11,76 = 86,24 г n(H2O) = N(H2O) = 4,79×6,02×1023 = 28,8425×1023 молекул Задача 6.При 100°С у 100 г води розчиняється 347 г натрій гідроксиду. а). Яка масова частка NaOH в отриманому розчині? б). Яка мольна частка NaOH в отриманому розчині? в). Скільки молекул води припадає на 1 атом (точніше, йон) натрію в отриманому розчині? Розв’язок W(NaOH) = n(NaOH) = n(Н2О) = n(р-ну) = n(NaOH) + n(Н2О) = 8,675 + 5,556 = 14,231 моль c = N(Na) : N(H2O) = n(Na) : n(Н2О) = 8,675 : 5,556 = 1 : 0,64 Задача 7. Визначити молярну концентрацію розчину, який утворюється при змішуванні 300 см3 2М і 700 см3 4M розчинів сульфатної кислоти. Розв’язок
Задача 8. Визначте об’єм 7 М розчину сульфатної кислоти, який треба добавити до 120 мл 2 М розчину, щоб утворився 4 М розчин. Розв’язок . I спосіб Задачі на молярну концентрацію теж можна розв’язувати через „правило хреста”.
C3
ІІ спосіб V1(р-ну) = x; n1(H2SO4) = 7x; n2(H2SO4) = C×V = 2×0,120 = 0,24 моль
Задача 9.Визначте молярну концентрацію 22,54%-вого розчину фосфатної кислоти (r=1,315). Розв’язок Приймемо масу розчину за 100 г. Тоді маса фосфатної кислоти в розчині становитиме 22,54 г. n = V(р-ну) = С = Розчини Задача 10.У 100 г 20%-ного (за масою) водного розчину натрій гідроксиду обережно ввели x грам металічного натрію. У результаті реакції утворилося y г 40%-ного (за масою) розчину натрій гідроксиду. а). Знайдіть значення x i y. б). Обчисліть молярну концентрацію 40%-ного розчину натрій гідроксиду, якщо об’єм y грамів цього розчину в 7 разів менший об’єму 1 М розчину сульфатної кислоти, необхідної для його нейтралізації. Розв’язок a).
б). m(NaOH) = 100×0,2+40×0,641 = 45,64
Задача 11.Визначте об’єм 7 М розчину сульфатної кислоти, який треба добавити до 120 мл 2 М розчину, щоб утворився 4 М розчин. Розв’язок . I спосіб
C2 C1-C3
ІІ спосіб V1(р-ну) = x; n1(H2SO4) = 7x; n2(H2SO4) = C×V = 2×0,120 = 0,24 моль
Задача 12.Яку масу натрію слід добавити до 100 мл розчину натрій гідроксиду з масовою часткою 8% (густина розчину 1,085 г/мл), щоб одержати розчин з масовою часткою натрій гідроксиду 10%? Розв’язок 2Na + 2H2O = 2NaOH + H2 m1(NaOH) = 100×1,085 × 0,08 = 8,68 г n(Na) = x = n2(NaOH); n(H2) = 0,5x m(Na) = 23x; m2(NaOH) = 40x; m(H2) = x W¢(NaOH) = 8,68 + 40x = 10,85 + 2,2x 37,8x = 2,17 x = 0,0574 m(Na) = 0,0574×23 = 1,32
Поиск по сайту: |

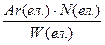
 ; W =
; W = 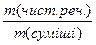 ;
W(ел.) =
;
W(ел.) = 
 ; j =
; j = 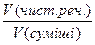 ;
;

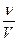
 ; r =
; r = 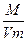
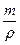 ; V = n×Vm
; V = n×Vm
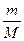 ; n =
; n = 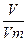 ;n =
;n = 

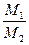 ; D =
; D = 
 ; h =
; h = 

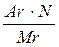 ;
; 
 ; Mr(X2YO4) =
; Mr(X2YO4) = 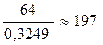

 , знайдемо молярну масу сполуки E2CrO4.
, знайдемо молярну масу сполуки E2CrO4. ; Mr(E2CrO4) =
; Mr(E2CrO4) =  » 194
» 194 = 39
= 39
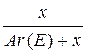
 ;
; 

 = 618
= 618 = 530
= 530 , знайдемо відносну молекулярну масу хлориду невідомого елемента:
, знайдемо відносну молекулярну масу хлориду невідомого елемента: Mr(EClx) =
Mr(EClx) = 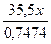 = 47,5x
= 47,5x ; n(P) =
; n(P) =  ; n(O) =
; n(O) = 

 :
:  = 1,25:1,25:3,75 = 1:1:3
= 1,25:1,25:3,75 = 1:1:3 = 268
= 268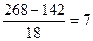 ; Na2SO4∙7H2O
; Na2SO4∙7H2O W1
W1

 W3
W3

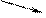 48,5
48,5

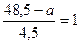
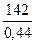 = 323
= 323 ; Na2SO4∙10H2O
; Na2SO4∙10H2O

 ;
; 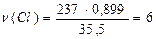
 3,45:3,45:3,45 = 1:1:1
3,45:3,45:3,45 = 1:1:1 = 4,63:6,97:2,34 = 2:3:1
= 4,63:6,97:2,34 = 2:3:1 2,985:4,48:3,73 = 1:1,5:1,25 = 4:6:5
2,985:4,48:3,73 = 1:1,5:1,25 = 4:6:5 моль
моль

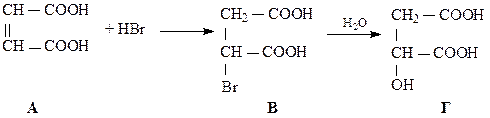

 - 4,9 = 0
- 4,9 = 0 KCl + KClO + H2O
KCl + KClO + H2O 5KCl + 3H2O
5KCl + 3H2O ; n(Н) =
; n(Н) =  ; n(О) =
; n(О) = 

 ; n(H) =
; n(H) =  ; D – C7H8
; D – C7H8

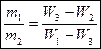 – формула правила змішування
– формула правила змішування W1
W1




 W1 W3-W2
W1 W3-W2 W3
W3  W2 W1-W3
W2 W1-W3
 1,225 0,245
1,225 0,245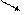
 0,49
0,49

 моль
моль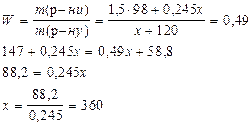
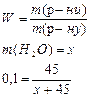

 ; m2(H2SO4) = 98×
; m2(H2SO4) = 98×  , тоді маса солі у кристалогідраті дорівнює
, тоді маса солі у кристалогідраті дорівнює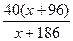

 ;
; моль
моль моль
моль 0,7763 або 77,63%
0,7763 або 77,63% = 8,675 моль = n(Na)
= 8,675 моль = n(Na) 5,556 моль
5,556 моль = 0,6096 або 60,96%
= 0,6096 або 60,96%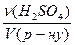 Визначимо кількість речовини сульфатної кислоти у першому розчині:
n1(H2SO4) = C1(H2SO4)×V1(р-ну)
n1(H2SO4) = 2 моль/л×0,3 л = 0,6 моль
Визначимо кількість речовини сульфатної кислоти у другому розчині:
n2(H2SO4) = 4 моль/л×0,7 л = 2,8 моль
Кількість речовини сульфатної кислоти дорівнюватиме сумі кількостей речовини кислотив першому і другому розчині:
n(H2SO4) = n1(H2SO4) + n2(H2SO4)
n(H2SO4) = = 0,6 моль + 2,8 моль = 3,4 моль
V(р-ну) = 300см3 + 700 см3 = 1000 см3 = 1 л
С(H2SO4) =
Визначимо кількість речовини сульфатної кислоти у першому розчині:
n1(H2SO4) = C1(H2SO4)×V1(р-ну)
n1(H2SO4) = 2 моль/л×0,3 л = 0,6 моль
Визначимо кількість речовини сульфатної кислоти у другому розчині:
n2(H2SO4) = 4 моль/л×0,7 л = 2,8 моль
Кількість речовини сульфатної кислоти дорівнюватиме сумі кількостей речовини кислотив першому і другому розчині:
n(H2SO4) = n1(H2SO4) + n2(H2SO4)
n(H2SO4) = = 0,6 моль + 2,8 моль = 3,4 моль
V(р-ну) = 300см3 + 700 см3 = 1000 см3 = 1 л
С(H2SO4) =  = 3,4 моль/л
= 3,4 моль/л

 7 4-2
7 4-2
 4
2 7-4
4
2 7-4
 C1 C3-C2
C1 C3-C2
 C2 C1-C3
C2 C1-C3

 = 0,23 моль
= 0,23 моль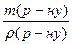 ; V(р-ну) =
; V(р-ну) =  мл = 0,076 л
мл = 0,076 л » 3,03 моль/л
» 3,03 моль/л



 C1 C3-C2
C1 C3-C2
 C3
C3 

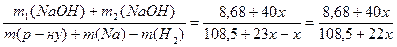 =0,1
=0,1