 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Обчислення кількості речовини, маси або об’єму продукту реакції за відомою кількістю речовини, масою або об’ємом вихідної речовини, яка містить домішки
Задача 1. Обчисліть масу ванадію, який можна добути шляхом алюмотермічного відновлення оксидного концентрату масою 200 г (масова частка V2O5 становить 89%). Знайдіть масу технічного алюмінію (W(Al) – 92%), який знадобиться для відновлення. Розв’язок 3V2O5 + 10Аl = 5Al2O3 + 6V Обчислимо масу чистого V2O5 у концентраті. m(V2O5) = W(V2O5)×m(концентрату) m(V2O5) = 0,89×200 г = 178 г Знайдемо кількість речовини V2O5. n = За рівнянням реакції кількість речовини ванадію буде в 2 рази більша від кількості речовини ванадій оксиду. n(V) = 2n( V2O5) = 0,978×2 = 1,956 моль m = n×M m(V) = 1,956 моль×51 г/моль = 99,76 г За рівнянням реакції кількість речовини алюмінію становитиме n(Al) = m(Al) = 6,52 моль×27 г/моль = 176,04 г Маса технічного алюмінію становитиме: m(суміші) = m(техн. Al) = Задача 2.Цинк добувають випалюванням цинкової обманки (цинк сульфіду) з наступним відновленням одержаного оксиду коксом. Яку масу цинку можна одержати з 800 г руди, що містить 63,05% цинк сульфіду? Розв’язання 2ZnS + 3O2 = 2ZnO + 2SO2 (1) ZnO + C = Zn + CO (2) m(чист. р-ни) = m(суміші) ∙ W m(ZnS) = 800 г ∙ 0,6305 = 504,4 г n = n(ZnS) = Аналізуючи рівняння реакцій (1) і (2), приходимо до висновку, що: n(Zn) = n(ZnS) = 5,2 моль m = n∙M m(Zn) = 5,2 моль ∙ 65 г/моль = 338 г Задача 3.Залізо добувають випалюванням піриту, що містить 60% ферум(ІІ) сульфіду, з наступним відновленням ферум(ІІІ) оксиду карбон(ІІ) оксидом. Яку масу металу можна добути з піриту масою 200 кг? Розв’язання 4FeS + 11O2 = 8SO2 + 2Fe2O3 (1) Fe2O3 + 3CO = 2Fe + 3CO2 (2) m(чист. р-ни) = m(суміші) ∙ W m(FeS2) = 200 г ∙ 0,6 = 120 г n = n(FeS) = Аналізуючи рівняння (1) і (2): n(Fe) = n(FeS) = 1 моль m = n∙M m(Fe) = 1 моль ∙ 56 г/моль = 56 г Задача 4.У результаті алюмотермії був одержаний марганець масою 55 г Яка маса руди прореагувала, якщо масова частка манган(IV) оксиду в ній становить 90%? Розв’язок 3MnO2 + 4Al = 2Al2O3 + 3Mn n = n(Mn) = За рівнянням реакції n(MnO2) = n(Mn) = 1 моль m = n × M m(MnO2) = 1 моль × 87 г/моль = 87 г m(руди) = m(руди) = Задача 5.Визначити масу 10%-ного розчину хлоридної кислоти в якій треба розчинити 12,5 г магнію, який містить 4% домішок, що не розчиняться в хлоридній кислоті. Розв’язок Mg + 2HCl = MgCl2 + H2 W(Mg) = 100% - 4% = 96% m(чист. р-ни) = m(суміші) ∙ W m(Mg) = 12,5 г × 0,96 = 12 г n = n(Mg) = За рівнянням реакції n(HCl) = 2n(Mg) = 1 моль m = n × M (HCl) = 1 моль × 36,5 г/моль = 36,5 г m(р-ну) = m(р-ну) = Задача 6.Хлороводень, добутий із зразка технічного натрій хлориду масою 9,6 г, використали для добування концентрованої хлоридної кислоти. Вся добута кислота вступила в реакцію з манган(IV) оксидом. При цьому утворився газ об’ємом 896 мл (н.у.). Визначити масову часту натрій хлориду у вихідному зразку. Розв’язок NaCl + H2SO4 = NaHSO4 + HCl (1) MnO2 + 4HCl = MnCl2 + Cl2 + H2O (2) n = n(Cl2) = За рівнянням реакції (2) n(HCl) = 4n(Cl2) = 4 × 0,04 моль = 0,16 моль За рівнянням реакції (1) n(NaCl) = n(HCl) = 0,16 моль m = n × M m(NaCl) = 0,16 моль × 58,5 г/моль = 9,36 г W = W(NaCl) = Задача 7.Масова частка целюлози у деревині дорівнює 50%. Яку масу спирту можна добути під час бродіння глюкози, що утворюється при гідролізі деревних ошурок масою 729 кг? Урахувати, що спирт виділяється у реакційній системі у вигляді розчину з масовою часткою води 8%. Вихід етанолу становить 70%. Розв’язок (C6H10O5)n +nH2O ® nC6H12O6 (1) C6H12O6 W = m(цел.) = W(цел.) × m(дерев.) m(цел.) = 0,5 × 729 кг = 364,5 кг n = n(цел.) = За рівняннями реакцій (1) і (2) n(C2H5OH) = 2n(цел.) = 4,5 кмоль m = n × M m(C2H5OH) = 4,5 × 46 = 207 кг Оскільки вихід спирту становить 70%, то маса практична спирту дорівнюватиме: h = m(практична) = h × m(теоретична) mпр.(C2H5OH) = 0,7 × 207 = 144,9 кг W = m(р-ну) = m(р-ну) =
Поиск по сайту: |
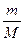 ; n(V2O5) =
; n(V2O5) =  0,978 моль
0,978 моль n(V2O5)
n(V2O5)
 = 191,35 г
= 191,35 г = 5,2 моль
= 5,2 моль = 1 моль
= 1 моль = 1 моль
= 1 моль
 = 96,67 г
= 96,67 г = 0,5 моль
= 0,5 моль
 = 365 г
= 365 г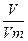
 = 0,04 моль
= 0,04 моль
 = 0,975, або 97,5%
= 0,975, або 97,5% 2C2H5OH + 2CO2 (2)
2C2H5OH + 2CO2 (2) = 2,25 кмоль
= 2,25 кмоль
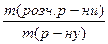
 = 157,5 кг
= 157,5 кг