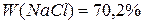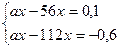|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Обчислення за рівняннями хімічних реакцій між розчином солі та металом
Задача 1.Хромова пластинка масою 31,2 г занурена в 250 мл 4 М розчину купрум(ІІ) сульфату. Через деякий час маса хромової пластики збільшилася на 6 г. Обчисліть масу купрум(ІІ) сульфату, що залишився в розчині. Розв’язок Cr + CuSO4 = CrSO4 + Cu У вихідному розчині кількість речовини купрум(ІІ) сульфату становила: С = n = С×V n(CuSO4) = 0,25 л × 4 моль/л = 1 моль За рівнянням реакції всі кількості речовин рівні. Приймемо: n(Cu) = n(Cr) = n1(CuSO4) = x m(Cu) = 64x m(Cr) = 52x m1(CuSO4) = 160x Зміна маси пластинки відбулася за рахунок того, що певна маса міді осіла на пластинці, а певна маса хрому перейшла в розчин у вигляді йонів Cr2+/ m(пласт.) + m(Cu) – m(Cr) = m¢(пласт.) m(Cu) – m(Cr) = Dm(пласт.) 64x – 52 = 6 12x = 6 x = 0,5 Отже, у розчині було 0,5 моль купрум(ІІ) сульфату, з них прореагувало 0,5 моль, а в розчині залишилося 0,5 моль. Звідси маса купрум(ІІ) сульфату, що залишився в розчині, становитиме: m = n×M m¢(CuSO4) = 0,5 моль × 160 г/моль = 80 г Задача 2.У 250 г 25%-ного розчину цинк нітрату занурили магнієву пластинку. Визначити масові частки речовин в утвореному розчині, якщо маса магнієвої пластинки збільшилась на 4,1 г. Розв’язок Mg + Zn(NO3)2 = Mg(NO3)2 + Zn За рівнянням реакції всі кількості речовини рівні. Приймемо, що n(Mg) = n(Zn(NO3)2) = n(Mg(NO3)2) = n(Zn) = x m = n×M m(Mg) = 24x m(Zn(NO3)2) = 189x m(Mg(NO3)2) = 148x m(Zn) = 65x m(пласт.) + m(Zn) – m(Mg) = m¢(пласт.) m(Zn) – m(Mg) = Dm(пласт.) 65х – 24х = 4,1 41х = 4,1 х = 0,1 У вихідному розчині маса цинк нітрату становила: m(розч. р-ни) = W×m(розчину) m(Zn(NO3)2) =0,25 × 250 = 62,5 г n = n(Zn(NO3)2) = У реакцію вступив 0,1 моль цинк нітрату, отже, у розчині після реакції залишилося: n¢(Zn(NO3)2) = 0,33 моль – 0,1 моль = 0,23 моль m¢(Zn(NO3)2) = 0,23 моль × 189 г/моль = 43,47 г У результаті реакції утворилося 0,1 моль магній нітрату. Маса магній нітрату в розчині після реакції складатиме: m(Mg(NO3)2) = 0,1 моль × 148 г/моль = 14,8 г Якщо маса пластинки збільшилася на 4,1 г, то маса розчину зменшиться на 4,1 г. m¢(р-ну) = 250 г – 4,1 г = 245,9 г W = W(Mg(NO3)2) = W¢(Zn(NO3)2) = Задача 3.Кусочок заліза помістили в розчин нітрату невідомого металу, який проявляє в сполуках ступінь окислення +2. Маса зразка металу збільшилась на 1,6 г. Через одержаний розчин ферум(ІІ) нітрату пропустили надлишок сірководню, одержавши ферум(ІІ) сульфід масою 17,6 г. Який метал виділився із розчину? Розв’язок Fe + Me(NO3)2 = Fe(NO3)2 + Me (1) Fe(NO3)2 + H2S = FeS¯ + 2HNO3 (2) n = n(FeS) = За рівняннями реакцій (1) і (2): n(H2S) = n(Fe(NO3)2) = n(Fe) = n(Me) = 0,2 моль m(Fe) = 56 × 0,2 = 11,2 Приймемо, що Mr(Me) = a m(Me) = 0,2а m(пласт.) + m(Me) – m(Fe) = m¢(пласт.) m(Me) – m(Fe) = Dm(пласт.) 0,2a – 11,2 = 1,6 0,2а = 12,8 а = 64 Метал – мідь Задача 4.Дві пластинки, що мають однакову масу і виготовлені з металу, що утворює двозарядні йони, занурили одну в розчин купрум(ІІ) нітрату, а другу – у розчин станум(ІІ) нітрату. Через деякий час маса пластинки, зануреної в розчин купрум(ІІ) нітрату, зменшилась на 0,2%, а маса другої пластинки збільшилась на 10,8%. Зменшення молярної концентрації обох розчинів було однаковим. Визначте метал. Розв’язок Me + Cu(NO3)2 = Me(NO3)2 + Cu Me + Sn(NO3)2 = Me(NO3)2 + Sn Якщо прийняти масу пластинки за 100 г, то в першому випадку її маса зменшилася на 0,2 г, а в другому – збільшилася на 10,8 г. Оскільки зменшення молярної концентрації обох розчинів було однаковим, то в обох реакціях прореагувала однакова кількість речовини Приймемо: n(Me) = n(Cu) = n(Sn) Приймемо Mr(Me) = a m(Me) = ax m(Cu) = 64x m(Sn) = 119x m1(пласт.) + m(Cu) – m(Me) = m¢(пласт.) m(Cu) – m(Me) = Dm(пласт.) m2(пласт.) + m(Sn) – m(Me) = m¢(пласт.) m(Sn) – m(Me) = Dm(пласт.)
Віднявши від другого рівняння перше, одержимо: 55х = 11 х = 0,2 Підставимо значення х у перше рівняння системи двох рівнянь: 64×0,2 – 0,2а = –0,2 13 = 0,2а а = 65 Невідомий метал – цинк. Задача 5.У 200 г розчину купрум сульфату з масовою часткою солі 6% занурили залізну пластинку. Визначте масову частку (%) купрум сульфату та ферум сульфату в утвореному розчині, якщо маса залізної пластинки збільшилась на 0,32 г. Розв’язок CuSO4 + Fe = FeSO4 + Cu n(CuSO4) = n(Fe) = n(FeSO4) = n(Fe) = х (за рівнянням реакції) m(CuSO4) = 160x; m(Fe) = 56x; m(FeSO4) = 152x; m(Fe) = 56x Маса пластинки змінилася за рахунок того, що 64х г Сu осіло на пластинці, а 56х г Fe з пластинки перейшло в розчин. Отже: 64х - 56х = 0,32 8х = 0,32 х = 0,04 (моль) Визначимо масу CuSO4, що вступила в реакцію, та масу FeSO4, що утворилася в результаті реакції: m1(CuSO4) = 160×0,04 = 6,4 г; m(FeSO4) = 152×0,04 = 6,08 г У вихідному розчині маса CuSO4 становила: m(CuSO4) = m(р-ну)×W = 200×0,06 = 12 г Отже, після реакції в розчині залишилося CuSO4: m2(CuSO4) = 12 г - 6,4 г = 5,6 г Якщо маса пластинки збільшилася на 0,32 г, то маса розчину зменшилася на 0,32 г. Отже, m¢(р-ну) = 200 г - 0,32 г = 199,68 г Визначимо масові частки солей в новоутвореному розчині:
Задача 6.Зразок, що містить хлориди натрію і калію, має масу 25 г. До водного розчину зразка додали 840 мл розчину AgNO3 (0,5 моль/л). Осад відфільтрували, після чого опустили в розчин мідну пластинку масою 100 г. Через деякий час маса пластинки становила 101,52 г. Розрахуйте масові частки компонентів вихідної суміші. Розв’язок n(Ag(NO3) = 0,5·0,84 = 0,42 a a KCl + AgNO3 = AgCl¯ + KNO3 b b NaCl + AgNO3 = AgCl¯ + NaNO3 x 2x 2x Cu + 2AgNO3 = Cu(NO3)2 + 2Ag 216x – 64x = 1,52 x = 0,01 n1(AgNO3) = 0,02 n2(AgNO3) = 0,42-0,02 = 0,4
b = 0,3; a = 0,1
Задача 7.У водний розчин хлориду деякого двовалентного металу, що має об'єм 10 мл, опустили залізну пластинку масою 10 г. Після того, як метал з розчину повністю осів на пластинку, її маса збільшилася до 10,1 г. Потім в таку ж кількість досліджуваного розчину опустили кадмієву пластинку масою 10 г і після завершення реакції її маса зменшилася до 9,4 г. Хлорид якого металу містився в досліджуваному розчині? Поясніть процеси, що відбуваються, приводячи рівняння відповідних хімічних реакцій. Розв’язання МеСl2 + Fe = FeCl2 + Me За рівнянням реакції: n(Fe) = n(Ме) = х m(Fe) = 56x m(Me) = ax, де а – відносна атомна маса металу m(пл.) + m(Me) – m(Fe) = m¢(пл.) 10 + ах – 56х = 10,1 ах – 56х = 0,1 МеСl2 + Cd = CdCl2 + Me За рівнянням реакції: n(Cd) = n(Ме) = х m(Cd) = 112x m(Me) = ax m(пл.) + m(Me) – m(Cd) = m¢(пл.) 10 + ах – 112х = 9,4 ах – 112х = -0,6 Складаємо систему двох рівнянь:
56х = 0,7; х = 0,0125 Підставляємо значення х у перше рівняння системи: 0,0125а - 56×0,0125 = 0,1 а = 64 Метал – мідь
Поиск по сайту: |
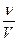
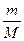
 = 0,33 моль
= 0,33 моль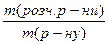
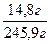 0,06, або 6%
0,06, або 6%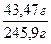 0,1768, або 17,68%
0,1768, або 17,68%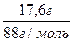 = 0,2 моль
= 0,2 моль
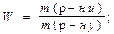
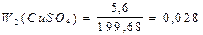 , або 2,8%;
, або 2,8%;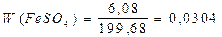 , або 3,04%
, або 3,04%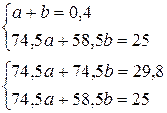
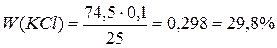 ;
;