 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Обчислення еквівалента елемента за формулою та еквівалента речовини за рівнянням хімічної реакції
Задача 1.При взаємодії з водою 1,6 г металу виділилося 0,896 л (н.у.) водню. Визначте еквівалент металу. Розв’язок І спосіб Цю задачу можна розв’язати за методом витіснення. Береться до уваги маса металу, що витісняє водень, і масу витісненого водню. Еквівалент хімічного елемента обчислюють за формулою Е = де q – маса взятого металу m – маса витісненого водню в г. n = n(Н2) = m(H2) = 0,04 моль × 2 г/моль = 0,08 моль Е(Ме) = ІІ спосіб Е(Н2) = Е(Н2) = nекв.(Н2) = Така кількість водню виділиться тоді, коли прореагує 0,08 г-екв. металу. Е(Ме) = Задача 2.При обробці 1,08 г металу хлором утворилося 5,34 г його хлориду. Визначте еквівалент металу. І спосіб m(Cl) = 5,34 г – 1,08 г = 4,26 г Е(Cl) = Металу теж прореагувало 0,12 г-екв., а його еквівалент дорівнює Е(Ме) = ІІ спосіб m(Cl) = 5,34 г – 1,08 г = 4,26 г Е(Cl) = 4,26 г хлору реагує з 1,08 г металу 35,5 – х х = Задача 3.Дві бінарні сполуки складаються з одного і того ж елемента ІІ групи періодичної системи та різних неметалічних елементів. Різниця молярних мас еквівалентів сполук становить 18, а відношення молярних мас їх еквівалентів – 1,95. Установити про які речовини йдеться. Розв’язок ExA2 i EyB2. Позначимо еквівалентну масу ExA2 – Е1, а EyB2 – Е2.Тоді:
E1 = 1,95E2 1,95E2 - E2 = 18 0,95E2 = 18; E2 = 19; E1 = 37. Еквівалент металу повинен бути менше 19 (це або В, або Mg). Якщо це Mg, то його сполука з неметалом – сіль. Еквівалент солі = Отже, Mr(MgxA2) = 2x×E1 = 74х, де х – валентність металу. Ar(A) =
Сполука MgxA2 – Mg3As2. Mr(MgxA2) = 2x×E2 = 38x; Ar(A) =
Сполука MgN не існує, отже це сполука Mg2Si. Якщо Е – В, то задача не має розв’язку. Виведення молекулярної формули речовини Задача 1.При спалюванні 7,3 г невідомої речовини утворилося 8,96 л вуглекислого газу (н.у.), 1,12 л азоту, 9,9 г води. Установіть формулу речовини, якщо відносна густина її пари за воднем 36,5. Обчисліть, скільки молекул даної речовини міститься у 7,3 г цієї речовини. Розв’язок
m = n×M; m(C) = 0,4×12 = 4,8 г; m(H) = 1,1×1 = 1,1 г; m(N) = 0,1×14 = 1,4 г m(C) + m(H) + m(N) = 4,8 + 1,1 + 1,4 = 7,3 г Отже, до складу невідомої речовини входили елементи С, H, N: CxHyNz
Найпростіша формула невідомої речовини C4H11N Mr(C4H11N) = 73 Mr(CxHyNz) = DH2×Mr(H2) = 36,5×2 =73 Отже, справжня формула невідомої речовини C4H11N
Задача 2.Металічна пластинка масою 50 г після перебування в розчині хлоридної кислоти зменшилася в масі на 1,68%, при цьому виділилось 0,336 л газу. Із якого металу може бути виготовлена пластинка? Розв’язок n(Ag(NO3) = 0,5·0,84 = 0,42 a a KCl + AgNO3 = AgCl¯ + KNO3 b b NaCl + AgNO3 = AgCl¯ + NaNO3 x 2x 2x Cu + 2AgNO3 = Cu(NO3)2 + 2Ag 216x – 64x = 1,52 x = 0,01 n1(AgNO3) = 0,02 n2(AgNO3) = 0,42-0,02 = 0,4
b = 0,3; a = 0,1
Задача 3.При доливанні розчину, що містить 2,04 г солі сірководневої кислоти, до розчину, що містить 2,7 г хлориду двохвалентного металу, випало 1,92 г осаду. Які солі взяті для проведення реакції, якщо вони прореагували повністю? Розв’язок Маса осаду не перевищує масу одного з реагентів, отже, в осад випала одна речовина: хлорид чи сульфід. Для всіх металів, хлориди яких нерозчинні, сульфіди теж нерозчинні. Отже, в осад випав сульфід. MCl2 ® MS¯ n(MCl2) = n(MS) = 0,78a = 49,92; a = 64 (Cu) n(CuCl2) = 1) xCuCl2 +Me2Sx = xCuS¯ + 2MeClx 2) xCuCl2 + 2Me(HS)x = xCuS + 2MeClx + xH2S 1) n(Me2Sx) = Mr(Me2Sx) = 2a + 32x = 102x a = 35x
3) n(Me(HS)x) = M(Me(HS)x) = a + 33x = 51x a = 18 x
2NH4HS + CuCl2 = CuS¯ + NH4Cl + H2S Задача 4.Невідомий метал масою 13 г обробили надлишком розбавленого розчину нітратної кислоти. До одержаного розчину додали надлишок гарячого розчину калій гідроксиду; при цьому виділилось 1,12 л газу (н.у.). Який метал був розчинений в нітратній кислоті? Розв’язок 8Me + 10xHNO3 = 8Me(NO3)x + xNH4NO3 + 3xH2O NH4NO3 + KOH = KNO3 + NH3 + H2O n(NH3) = n(Me) = M(Me) = 13 :
Задача 5.Кристалогідрат солі металу масою 8,22 г із загальною формулою МSO4·7H2O був розчинений в 50 мл води. Виміряна через деякий час масова частка речовини в розчині виявилась рівню 8,51%. Визначте, про який метал іде мова? Розв’язок m(p) = 50 + 8,22 = 58,22 m(MeSO4) = 58,22·0,0851 = 4,9545
8,22a + 789,12 = 4,9545a + 1099,899 3,2655a = 310,779 a = 95 Такого металу немає. Поскільки концентрація виміряна не зразу, в розчині пройшла реакція. Сульфати не розкладаються і повністю не гідролізуються. Отже – сульфат взаємодіє з водою: MSO4 + H2O ® MOHSO4 + 0,5H2
a = 52 (Cr) 2CrSO4 + 2H2O = 2CrOHSO4 + H2 Задача 6.Визначте будову і назвіть сполуку бензольного ряду складу С9Н8, якщо відомо, що вона знебарвлює бромну воду, вступає в реакцію Кучерова, реагує з амідом натрію. При окисленні перманганатом калію вихідна речовина дає бензойну кислоту. Розв’язок
Задача 7.Розчин деякої солі, що має лужну реакцію, при нагріванні повільно нейтралізували хлоридом амонію. На це витратилося 2,675г NH4Cl; в результаті виділилося 1,70 г суміші газоподібних речовин, а сухий залишок після випарювання отриманого розчину являв собою хлорид натрію. Визначте вихідну сіль, якщо відомо, що вона не проявляє окислювальних властивостей. Розв’язок Так як сухий залишок містить лише NaCl, а вихідна сіль повинна містити кислотний залишок, то гази, що виділилися в реакції – аміак і гідрид кислотного залишку. Нехай x – валентність кислотного залишку A , тоді: NaxA + xNH4Cl ® xNaCl + HxA + xNH3 n(NH4Cl) = m(NH3) = 0,05·17 = 0,85 г m(HxA) = 1,7-0,85 = 0,85 г (x+A)· 0,05x + 0,05A = 0,85x 0,05A = 0,8x При х = 2, А = 32 (S) Na2S + 2NH4Cl ® 2NaCl + H2S + 2 NH3 Задача 8.Сіль одновалентного металу масою 74,4 г нагріли в закритій посудині, при цьому одержали 26,8 мл безбарвної рідини з концентрацією речовини 11,2 моль/л. Визначити формулу солі, якщо відомо, що вона містить метал, водень, 25,8% сірки і 51,61% кисню. Розв’язок
На метал і водень в 1 моль солі припадає: m(Me) + m(H) = 248 - (2×32 + 8×16) = 56 Із одновалентних металів, солі яких стійкі у водних розчинах, підходять Li, Na, K. Якщо метал Na, то сіль – натрій тіосульфат: Na2S2O3×5H2O. Задача 9.При обробці нітруючою сумішшю ароматичної речовини А, молекулярна формула якої С8Н10, утворюється переважно дві речовини, В і В¢, з молекулярною формулою С8Н9О2N. При окисненні речовини А підкисленим водним розчином KМnO4 утворюється речовина С з молекулярною формулою С7Н6О2. Окиснення в тих же умовах речовин В і В¢ дає ізомерні речовини D i D¢. Установіть будову речовин А, В, В¢, С, D i D¢. Розв’язок Речовина А може мати такі структурні формули:
Так як при окисненні А утворює сполуку з меншою кількістю атомів Карбону, то речовина А – етилбензол (І)
Задача 10.Унаслідок спалювання 2,3 г речовини утворилося 4,4 г оксиду вуглецю (IV) і 2,7 г води. Густина пари речовини за повітрям становить 1,59 (н.у.). Знайдіть молекулярну формулу речовини. Розв’язок
n(С) : n(Н) : n(O) = 0,1:0,3:0,05=2:6:1 Mr(С2Н6О) = 46 Mr(CxHy) = 1,59×29 = 46 C2H6O – це може бути або етиловий спирт – С2Н5ОН, або диметиловий ефір СН3-О-СН3 Задача 11.У оксиді Молібдену відношення маси Молібдену до маси Оксигену дорівнює двом. Визначте найпростішу формулу оксиду. Розв’язок Мо2Ох
192 = 32х х = 6 Мо2О6, а найпростіша формула МоО3 Задача 12.Дієновий вуглеводень масою 2,7 г повністю прореагував з 2,24 л гідрогенброміду (н.у.) Знайдіть молекулярну формулу сполуки. Розв’язок CnH2n–2 + 2HBr ® CnH2nBr2 n(HBr) = За рівнянням реакції кількість речовини дієнового вуглеводню в 2 рази менша від кількості речовини гідрогенброміду. n(CnH2n–2) = n = М = М(CnH2n–2) = 12n + 2n – 2 = 54 14n = 56 n = 4 C4H6 – бутадієн
Поиск по сайту: |
 ,
,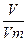
 = 0,04 моль
= 0,04 моль = 20
= 20
 = 11,2
= 11,2 = 0,08
= 0,08 = 0,12
= 0,12 = 9
= 9 = 9
= 9

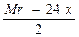
 = 7x
= 7x
 моль; n(Н)=2n(Н2О)=0,55×2=1,1 моль;
моль; n(Н)=2n(Н2О)=0,55×2=1,1 моль;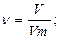
 моль = n(С);
моль = n(С); моль; n(N) = 2n(N2) = 0,1 моль;
моль; n(N) = 2n(N2) = 0,1 моль;
 моль; N = n×NA = 0,1×6,02×1023 = 6,02×1022
моль; N = n×NA = 0,1×6,02×1023 = 6,02×1022
 ;
; 


 2,7a + 86,4 = 1,92a + 136,32
2,7a + 86,4 = 1,92a + 136,32
 n(CuCl2) =
n(CuCl2) = 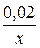

 n(CuCl2) =
n(CuCl2) = 

 = n(NH4NO3)
= n(NH4NO3)
 = 32,5x
= 32,5x

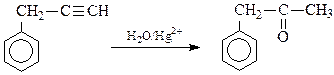




 = n(NH3)
= n(NH3) ·0,05 = 0,85
·0,05 = 0,85







 = 2
= 2 = 0,1 моль
= 0,1 моль n(HBr) = 0,05 моль
n(HBr) = 0,05 моль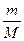

 = 54 г/моль
= 54 г/моль