 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Обчислення виходу продукту від теоретично можливого
Задача 1.Весь хлороводень, одержаний дією надлишку сульфатної кислоти на натрій хлорид масою 14,9 г, поглинули водою масою 200 г. Визначити масову частку хлороводню в розчині, якщо його вихід в реакції становив 70%. Розв’язок NaCl + H2SO4 = NaHSO4 + HCl n = n(NaCl) = За рівнянням реакції n(HCl) = n(NaCl) = 0,2547 моль m = n×M mтеор.(HCl) = 0,2547 моль × 36,5 г/моль = 9,3 г h = m(практична) = h × m(теоретична) mпракт.(HСl) = 0,7 × 9,3 г = 6,5 г m(розчину) = m(Н2О) + mпракт.(HСl) m(розчину) = 200 г + 6,5 г = 206,5 г W = W(HCl) = Задача 2.Через розчин масою 50 г з масовою часткою натрій іодиду 15% пропустили надлишок хлору. Виділився іод масою 5,6 г. Визначити вихід продукту реакції. 2NaI + Cl2 = 2NaCl + I2 n = n = n(NaI) = За рівнянням реакції n(І2) = m = n×M mтеор.(І2) = 0,025 моль × 254 г/моль = 6,35 г h = h(І2) = Задача 3.Яку масу манган(IV) оксиду і який об’єм розчину з масовою часткою HCl 36% (r=1,18 г/мл) треба взяти для одержання хлору, який може витіснити з розчину калій іодиду молекулярний іод масою 30,48 г? Вихід продукту на кожній стадії процесу становить 80% від теоретично можливого. Розв’язок MnO2 + 4HCl = Cl2 + MnCl2 (1) 2KI + Cl2 = 2KCl + I2 (2) h = mтеор. = mтеор.(I2) = n = n(І2) = За рівнянням реакції (2) n(Сl2) = n(I2) = 0,15 моль Вихід продукту реакції можна знайти і за кількістю речовини: h = n(теорет.) = nтеорет.(Сl2) = За рівнянням реакції (1) n( MnO2) = n(Сl2) = 0,1875 моль m = n×M m(MnO2) = 0,1875 моль×71 г/моль = 13,31 г n(HCl) = 4n(Cl2) = 0,1875 моль × 4 = 0,75 моль m(HCl) = 0,75 моль × 36,5 г/моль = 27,375 г W = m(р-ну) = m(р-ну HCl) = V = V(р-ну HCl) = Задача 4.У якому об’ємі води треба розчинити аміак, одержаний із 96,3 г амоній хлориду з виходом 60%, щоб концентрація одержаного розчину була рівною 0,5 моль/л? (r=1,12 г/мл). Розв’язок NH4Cl + NaOH = NaCl + NH3 + H2O n = n(NH4Cl) = За рівнянням реакції n(NH3) = n(NH4Cl) = 1,8 моль h = n(практ.) = h×n(теорет.) nпракт.( NH3) = 0,6×1,8 моль = 1,08 моль m = n×M m(NH3) = 1,08 моль × 17 г/моль = 18,36 г С = V = V(р-ну) = m = r×V m(р-ну) = 1,12 г/мл × 2160 мл = 2419,2 г m(H2O) = m(р-ну) – m(NH3) m(H2O) = 2419,2 г – 18,36 г = 2400,84 г Для води r = 1 г/мл Тоді V(H2O) = 2400,84 мл Задача 5.60 г металу ІІ А групи періодичної системи, взаємодіючи з азотом, утворює нітрид, який, реагуючи з водою, утворює гідроксид відповідного металу та аміак. При каталітичному окисненні аміаку, який виділився, утворюється 11,2 л нітроген(ІІ) оксиду (н.у.). Вихід становить 50%. Який це метал? Розв’язок 3Me + N2 = Me3N2 (1) Me3N2 + 6H2O = 3Me(OH)2 + 2NH3 (2) 4NH3 + 5O2 n = n(NO) = h = n(теорет.) = nтеорет.(NO) = За рівнянням реакції (2) n(Me3N2) = За рівнянням реакції (1) n(Ме) = 3n(Me3N2) = 3×0,5 моль = 1,5 моль n = M = M(Me) = Метал – Са Задача 6.Визначити об’єм азоту (н.у.) необхідний для добування 400 мл 70%-ного розчину нітратної кислоти (r=1,921 г/см3), якщо вихід продукту реакції на кожній стадії становить 60%. Яку масу калійної селітри можна одержати з цієї кислоти? Розв’язок N2 + O2 2NO + O2 = 2NO2 (2) 4NO2 + 2H2O + O2 = 4HNO3 (3) HNO3 + KOH = KNO3 + H2O (4) n = n = n(HNO3) = h = n(теорет.) = nтеорет.(HNO3) = За рівнянням реакції (3) n(NO2) = n(HNO3) = 14,23 моль nтеорет.(NO2) = За рівнянням реакції (2) n(NO) = n(NO2) = 23,72 моль nтеорет.(NO) = За рівнянням реакції (1) n(N2) = V = n×Vm V(N2) = 19,765 моль × 22,4 л/моль = 442,8 л За рівнянням реакції (4) n(КNO3) = n(HNO3) = 8,54 моль m = n×M m(KNO3) = 8,54 моль × 101 г/моль = 13,63 г Задача 7.Із технічного кальцій карбіду масою 200 г, масова частка домішок у якому становить 20%, одержали ацетилен. Обчислити масу розчинника 1,1,2,2-тетрахлоретану, який можна одержати з ацетилену, якщо вихід галогенопохідного становить 75%. Розв’язок CaC2 + 2H2O ® Ca(OH)2 + C2H2
W(CaC2) = 100% – 20% = 80% n = m(чист. р-ни) = W×m(суміші) n = n(CaC2) = n(CaC2) = n(C2H2) = n(C2H2Cl4) = 2,5 моль mтеорет.(C2H2Cl4) = 2,5 моль × 168 г/моль = 420 г h = mпракт. = h × m(теорет.) mпракт.(C2H2Cl4) = 420 г × 0,75 = 315 г Задача 8.Яку масу нітробензену можна добути при взаємодії бензену масою 780 г з нітратною кислотою масою 2 кг в присутності сульфатної кислоти, якщо масова частка практичного виходу нітробензену становить 80%. Розв’язок
n = n(С6Н6) = n(HNO3) = У недостачі бензол. За рівнянням реакції n(С6Н6) = n(С6Н5NO2) = 10 моль mтеорет.(С6Н5NO2) = 10 моль × 123 г/моль = 1230 г h = mпракт. = h × m(теорет.) mпракт.(C6H5NO2) = 0,8 × 1230 г = 984 г.
Поиск по сайту: |
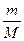
 = 0,2547 г
= 0,2547 г
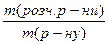
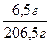 = 0,0315, або 3,15%
= 0,0315, або 3,15%
 = 0,05 моль
= 0,05 моль n(NaI) =
n(NaI) =  0,882, або 88,2%
0,882, або 88,2%
 = 38,1 г
= 38,1 г = 0,15 моль
= 0,15 моль

 моль
моль
 = 76,04 г
= 76,04 г
 64,44 мл
64,44 мл = 1,8 моль
= 1,8 моль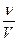

 = 2,16 л = 2160 мл
= 2,16 л = 2160 мл 4NO + 6H2O (3)
4NO + 6H2O (3)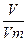
 = 0,5 моль
= 0,5 моль = 1 моль = n(NH3) – за рівнянням реакції (3)
= 1 моль = n(NH3) – за рівнянням реакції (3)
 = 40 г/моль
= 40 г/моль = 8,54 моль
= 8,54 моль = 14,23 моль
= 14,23 моль = 23,72 моль
= 23,72 моль = 39,53 моль
= 39,53 моль = 19,765 моль
= 19,765 моль
 = 2,5 моль
= 2,5 моль
 = 10 моль
= 10 моль = 31,75 моль
= 31,75 моль