 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Розрахунки за законом об’ємних відношень газів
Задача 1.До суміші 2 л метану й ацетилену добавлено 2 л водню. Після того, як уся суміш була пропущена над нагрітим платиновим каталізатором, її об’єм зменшився до 3,2 л, а продукти реакції не містили ненасичених вуглеводнів. Визначити об’ємні частки вуглеводнів у вихідній суміші якщо всі об’єми газів виміряні за однакових умов. Розв’язок З воднем реагуватиме лише ацетилен. НСºСН + 2Н2 ® Н3С–СН3 Нехай об’єм водню, який вступив у реакцію становить х л. Об’єми газів відносяться як кількості їх речовин, тоді об’єм ацетилену в 2 рази менший від об’єму водню і становить 0,5х л. Об’єм етану теж становить 0,5х л. 0,5х + х – 0,5х = 2 л +2 л – 3,2 л х = 0,8 л Об’єм ацетилену у вихідній суміші становив 0,4 л. Тоді об’єм метану був рівним: 2 л – 0,4 л = 1,6 л j = j(СН4) = j(С2Н2) = Задача 2.Спалили 42 мл суміші кисню і водню. Після реакції залишилося 6 мл кисню, що не прореагував. Визначте об’ємну частку кисню у вихідній суміші, якщо всі об’єми газів виміряні за однакових умов. Розв’язок 2Н2 + О2 = 2Н2О Визначимо сумарний об’єм кисню і водню, які прореагували. V(H2) + V1(O2) = 42 мл – 6 мл = 36 мл Водень і кисень реагують у співвідношенні 2 : 1 (за рівнянням реакції) Тоді: V(H2) = Об’єм кисню, що прореагував, у 2 рази менший від об’єму водню і становить 12 мл. Загальний об’єм кисню у вихідній суміші рівний: V(O2) = 12 мл + 6 мл = 18 мл. j(О2) = j(О2) =
Задача 3.До 120 мл суміші водню і азоту (н.у.) додали 150 мл кисню і підпалили. Після закінчення реакції і приведення газів до початкових умов їх об’єм становив 225 мл. Визначте об’ємні частки газів у вихідній суміші. Розв’язок Азот за звичайних умов з киснем і воднем не реагує. 2H2 + O2 ® 2H2O Нехай об’єм кисню, що вступив у реакцію: V(O2) = x Тоді V(Н2) = 2x Якщо продукти реакції привели до початкових умов, то вода – рідина. Отже: 2х + х = (120 + 150) – 225 = 45 х = 15 Кисень у надлишку. Отже, весь водень прореагував. V(Н2) = 2×15 = 30 мл V(N2) = 120 – 30 = 90 мл j(Н2) = j(N2) = Задача 4.До 400 мл суміші деякого вуглеводню з азотом додали 900 мл (надлишок) кисню і підпалили. Об’єм одержаної після згоряння суміші становив 1,4 л, а після конденсації парів води скоротився до 800 мл. Нове скорочення об’єму до 400 мл спостерігалося в результаті пропускання газів через розчин калій гідроксиду. Об’єми вимірювалися за однакових умов. Установіть формулу вуглеводню. Розв’язок СхHy + V(H2O) = 1400 – 800 = 600 мл Розчином калій гідроксиду поглинувся вуглекислий газ: V(СО2) = 800 – 400 = 400 мл Залишилося 400 мл азоту та кисню, який не прореагував. х = 400; Тоді об’єм кисню, який не прореагував: V¢(O2) = 900 – 700 = 200 мл Тоді у вихідній суміші вуглеводню було: V(СхHy) = 400 – 200 = 200 мл Об’єми газів відносяться як кількості їх речовини. n(СхHy):n(СО2):n(Н2О) = 200:400:600 = 2:4:6 = 1:2:3 n(С):n(Н) = 2:6 С2Н6 – етан Задача 5.Для повного спалювання 1 л невідомого газу знадобилось 2 л кисню. У результаті реакції виділилось 1 л азоту та 2 л вуглекислого газу. Знайдіть формулу спаленої речовини. Розв’язок А – невідомий газ. Об’єми газів відносяться як кількості їх речовини: А + 2О2 = N2 + 2CO2 Отже, до складу газу А входили елементи Нітроген і Карбон. Враховуючи кількості атомів Нітрогену і Карбону після реакції та той факт, що в реакцію вступив 1 моль речовини А, виводимо формулу газу А – С2N2.
Задача 6.Суміш нітроген(ІІ) і нітроген(IV) оксидів об’ємом 5,6 л (н.у.) змішали з 2 л кисню. Потім гази пропустили через розчин, що містив 30 г калій гідроксиду. Аналіз газу (0,5 л при н.у.), що пройшов через розчин, показав, що це кисень. Визначити склад вихідної газової суміші в об’ємних процентах і обчисліть масові частки речовин у розчині (кінцева маса розчину 1 кг). Розв’язок 2NO + O2 = 2NO2 4NO2 + O2 + 4KOH = 4KNO3 + 2H2O (1) 4NO + 3O2 + 4KOH = 4KNO3 + 2H2O (2) V(NO2) = x; V1(O2) = 0,25x V(NO) = y; V2(O2) = 0,75y V(O2) = 2 - 1,5 = 0,5 л
0,5x = 2,7; x = 5,4; y = 0,2
n(KNO3) = n(NO) + n(NO2) = m(KNO3) = 0,25·101 = 25,25 г
Задача 7.Обчисліть вміст метану в суміші з киснем, якщо відомо, що 36 мл газової суміші після спалювання метану зменшилась в об’ємі на 1,8 мл. Вважати, що пара води сконденсувалася повністю. Розв’язок x мл 2x x CH4 + 2O2 = CO2 + 2H2O x + 2x – x = 1,8 2x = 1,8 x = 0,9
Задача 8.Пропускаючи через надлишок розжареного вуглецю кисень, одержали 232 л газоподібних продуктів, виміряних при t=800°C i p=101,3 кПа. Густина одержаної суміші за воднем становила 17,2. Обчисліть об’єм кисню, що вступив у реакцію і склад (в % за об’ємом) утворених газів. Розв’язок C + O2 ® CO2 (1) CO2 + C ® 2CO (2) Оскільки об’єм одержаних газоподібних продуктів виміряний при t=800°C i p=101,3 кПа, визначимо, який об’єм вони займатимуть за нормальних умов.
Mr(сум.) = DH2×Mr(H2) = 17,2×2 = 34,4 Mr(сум.) = c1×Mr1 + c2×Mr2; c(CO2) = x, c(CO) = (1-x) 34,4 = 44x + 28(1-x) 6,4 = 16x; x = 0,4. c(CO2) = 0,4, c(CO) = 0,6 Для газів c=j. Отже, j(СО2) = 40%, j(СО) = 60% V(CO2) = j×V(сум.) = 0,4×59,027 = 23,611 л V(CO) = 0,6×59,027 = 35,416 л За рівнянням (2) V2(СO2) = V(CO2) = 23,611 + 17,708 = 41,319 л За рівнянням (1) V(O2) = V(CO2) = 41,319 л Задача 9.Суміш оксидів нітрогену(ІІ) і (IV) об’ємом 5,6 л (н.у.) змішали з 2 л кисню. Потім гази пропустили через розчин, що містив 30 г калій гідроксиду. Аналіз газу (0,5 л при н.у.), що пройшов через розчин, показав, що це кисень. Визначити склад вихідної газової суміші в об’ємних процентах і обчисліть масові частки речовин у розчині (кінцева маса розчину 1 кг). Розв’язок 2NO + O2 = 2NO2 4NO2 + O2 + 4KOH = 4KNO3 + 2H2O (1) 4NO + 3O2 + 4KOH = 4KNO3 + 2H2O (2) V(NO2) = x; V1(O2) = 0,25x V(NO) = y; V2(O2) = 0,75y V(O2) = 2 - 1,5 = 0,5 л
0,5x = 2,7; x = 5,4; y = 0,2
n(KNO3) = n(NO) + n(NO2) = m(KNO3) = 0,25·101 = 25,25 г
Задача 10.Об’єм суміші карбон(ІІ) оксиду з киснем становила 250 мл (н.у.). Після окиснення всього оксиду об’єм суміші виявився рівним 180 мл (н.у.). Одержану газову суміш пропустили в розчин, що містить 0,25 г натрій гідроксиду. Визначити склад (у % за об’ємом) вихідної суміші. Яка речовина утворилася в розчині після поглинання продуктів реакції? Відповідь підтвердити розрахунками. Розв’язок 2CO + O2 = 2CO2 V1(O2) = 250-180 = 70 V(CO) = 2V(O2) = 140 V(O2) = 250-140 = 110 j(CO) = j(O2) = n(CO2) = n(NaOH) = n(CO2) : n(NaOH) = 1 : 1 CO2 + NaOH = NaHCO3 Задача 11.У замкнутій посудині змішали водень, кисень і хлор. Густина отриманої газової суміші за азотом становила 0,4625. Відомо, що в суміші міститься в 14 раз більше водню, ніж хлору за об'ємом. Суміш газів зірвали і охолодили. Визначте масову частку кислоти в розчині, який виявили в посудині. Розв’язання Позначимо об'ємну частку (j) хлору через х. Тоді: j(Cl2) = х, j(H2) = 14х, j(O2) = 1 - 15х. Середня молекулярна маса суміші: M(суміші) = D×Mr(N2) = 0,4625×28 = 12,95 г/моль. Оскільки для газів об'ємна частка дорівнює мольній частці речовини, то: Мr(сум.) = j(Cl2)×Mr(Cl2) + j(H2)×Mr(Cl2) + j(O2)×Мr(O2) = 71х + 28х + 32(1 - 15х) Розв’язавши рівняння одержуємо: х = 0,05, звідси: j(Cl2) = 0,05, j(H2) = 0,70, j(O2) = 0,25. Нехай кількість газів початкової суміші рівно 1 моль (задача може бути вирішена і в загальному вигляді без цього припущення), тоді: n(Cl2) = 0,05 моль, n(H2) = 0,70 моль, n(O2) = 0,25 моль. При вибуху проходять наступні реакції: H2 + Cl2 ® 2HCl 2H2 + O2 ® 2H2O На взаємодію з указаними кількостями хлору і кисню потрібно 0,55 моль водню, значить Н2 – у надлишку, а обидва інших реагенти – у недостачі. Тоді: n(HCl) = 2×0,05 = 0,1 моль, m(HCl) = 0,1×36,5 = 3,65 г. n(H2О) = 2×0,25 = 0,5 моль, m(HCl) = 0,5×18 = 9,00 г. Маса розчину, що утворюється при розчиненні HCl: m(р-ну) = 3,65 + 9,00 = 12,65 г. W(HCl) = 3,65/12,65 = 0,29 (29%). Здача 12.20 мл водяного газу (суміш СО2, CO, H2 і N2) пропустили крізь розчин лугу. 19,2 мл газу, які залишилися, змішали в евдіометрі з 25 мл кисню і провели вибух. Після того, як в евдіометрі газова суміш набула попередньої температури і тиску, об’єм її дорівнював 25,2 мл. Потім утворену газову суміш знову пропустили крізь розчин лугу, від чого її об’єм зменшився на 8 мл. Обчислити процентний вміст газів за об’ємом. Розв’язок СO2 + 2NaOH = Na2CO3 + H2O N2 + O2 = 2NO 2H2 + O2 = 2H2O 2CO + O2 = 2CO2 V(CO2) = 20-19,2 = 0,8 мл; j(СО2) = V(СO) = V1(CO2) = 8 мл; j(СО) = V1(O2) = 4 мл DV = 19,2+25-25,2 = 19 мл V(H2)+V2(O2) = 19-4 = 15 мл V(H2) = V(N2) = 20 – (0,8+8+10) = 1,2 л; j(СО2) =
Поиск по сайту: |

 = 0,8 або 80%
= 0,8 або 80% = 0,2 або 20%
= 0,2 або 20% = 24 мл
= 24 мл
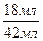 = 0,4286, або 43,86%
= 0,4286, або 43,86% = 0,25 або 25%
= 0,25 або 25%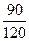 = 0,75 або 75%
= 0,75 або 75% O2 ® xCO2 +
O2 ® xCO2 +  H2O
H2O – диціан.
– диціан.



 , або 2,5%
, або 2,5% ;
; 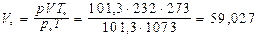 л
л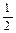 V(CO) = 17,708 л
V(CO) = 17,708 л

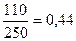


 =0,04
=0,04 =0,4
=0,4 = 10 мл; j(Н2) =
= 10 мл; j(Н2) = 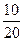 =0,5
=0,5 =0,06
=0,06