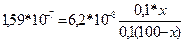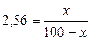|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Біохімічні буферні системи
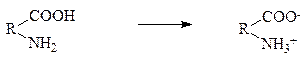
В організмі є 4 біохімічні буферні системи: гідрокарбонатна, фосфатна, гемоглобінова і білкова, кожна з них має в своєму складі слабку кислоту і її сіль з сильною основою. Гідрокарбонатні буферні системи - найбільш сильний буфер плазми крові і позаклітинної рідини. Значення рН плазми залежить від співвідношення компонентів буферної системи, яке для рН =7,4 складає: [ НСО3-] : [ Н2СО3] = 20 : 1 Робота гідрокарбонатної буферної системи спрямована на нейтралізацію кислих і лужних продуктів. Якщо у систему надходять кислі продукти (наприклад НСІ), то відбуваються такі протолітичні реакції: НСІ + Н20 = Сl + НзO+ NаНСО3 = Nа+ + НСО3- Н3О+ + НСО3- = Н2СО3 + Н2О Таким чином надлишкова концентрація йонів нейтралізується з утворенням слабкої карбонатної кислоти, надлишок якої в присутності ферменту карбоангідрази (КА) розкладається: Н2СО3 = СО2 + Н2О СО2 вилучається через легені і рівновага знову відновлюється. При надходженні лужних продуктів у реакцію вступає кисла частина буферної системи: NаОН = Nа+ +ОН- Н2СО3 + ОН- = НСО3- + Н2О У цьому випадку сильна основа зaмінюється йонами НСО3-, які виводяться нирками. Фосфатна система - найбільш сильний внутршньоклітинний фактор.Складається з : Н2PO4-+ НPO4-2. pН = 7,4 Білкова буферна система складається в основному з альбумінів плазми, які є амфолітами, бо містять всередині самої молекули як кислотні групи –СООН, які можуть взаємодіяти з основними факторами, так і аміногрупи -NH2, які маючи основні властивості взаємодіють з кислотними факторами.
Буферна система оксигемоглобін – гемоглобін характеризується рівновагою між йонами гемоглобіну Нb- і гемоглобіном ННb, який є досить слабкою кислотою (КHHb =6,3 . 10 -9) Нb- + Н3О+ = ННb + Н2О Нb- + Н2О = ННb + ОH- Гемоглобін HНb приєднює кисень і утворює оксигемоглобін HНb02 HНb + О2 = HНbО2 При цьому йони Нb02- теж взаємодіють з кислотними і основними факторами. HbО2- + Н3О+ = HНbО2 + Н2О HbО2- + Н2О = HНbО2 + ОН- Таким чином всі рівноваги гемоглобінової системи пов’язані між собою. Частка цієї буферної системи становить ~ 75% буферної ємності крові. Наявність таких буферних систем в організмі дозволяє нам переносити кислі і лужні продукти, які потім нейтралізуються і в цілому система людини має постійний кислотно-основний баланс. Особливо важливе значення кислотно-основний баланс має для стану зубів, які приймають на себе вплив з навколишнього середовища кислотних і основних факторів. Приклади роз’язування задач. Задача 1. Аміачна буферна система складається з 100 мл розчину гідроксиду амонію з молярною концентрацією еквівалентів 0,1 моль/л і 50 мл хлориду амонію з молярною концентрацією еквівалентів 0,2 моль/л. ( Розв'язок: Так як аміачна буферна система при дисоціації NH4OH = NH4+ + OH- утворює йони ОН-, то їх концентрацію можна розрахувати за формулою:
Якщо до даного розчину додати кислоти, то кількість основи в ньому зменшиться і згідно попереднього рівняння можна визначити концентрацію [OH-] в даному буфері:
Отже, рН системи зміниться із 9,25 до 9,16 Задача 2. Розрахуйте які об’єми розчинів гідрофосфату і дигідрофосфату натрію з молярними концентраціями еквівалентів 0,1 моль/л треба взяти для приготування 100 мл буферного розчину з рН 6,8. ( Розв'язок: Якщо буферний розчин має рН 6,8 то можна визначити концентрацію [H+] визначивши антилогарифм числа –6,8. -6,8=-7+0,2 10-6,8=100,2*10-7=1,59*10-7 Використавши попередню формулу:
Розв’язок рівняння
2,56(100-х) = х 256 = ,56*х х = 72 Отже, для приготування 100 мл фосфатного буферу необхідно взяти 72 мл розчину NaH2PO4 і 100-72 = 28 мл розчину Na2HPO4 з молярною концкнтрацією еквівалентів 0,1 моль/л. Заняття №6 Тема: Йонний добуток води. Водневий показник. Актуальність теми:Біохімічні процеси в організмі людини проходять у водних розчинах. При цьому водне середовище може бути нейтральним, кислим чи основним. Організм успішно справляється з кислотно-основною рівновагою і рН біологічних рідин залишається сталим, що забезпечує його нормальний життєвий рівень. Знання рН біологічних рідин дозволяє виявити патологічні зміни в організмі, попереджувати хвороби. Навчальні цілі: Знати: Значення рН шлункового соку, слини і інших біологічних рідин, від чого залежить значення рН різних розчинів. Вміти: Визначати рН розчинів за допомогою індикаторів. Розраховувати теоретичне значення рН різних розчинів. Самостійна позааудиторна робота студентів. 1. Напишіть рівняння гідролізу соди. 2. Концентрація водневих йонів в розчині 1.10-3 моль/л. Обчисліть рН і рОН розчину. Вкажіть середовище. 3. Концентрація гідроксильних йонів в розчині 1.10-3 моль/л. Обчисліть рН і рОН розчину. Вкажіть середовище. 4. Обчисліть рН розчину оцтової кислоти, хлоридної кислоти та гідроксиду амонію з молярною концентрацією еквівалентів 0,01 моль/л. Контрольні питання. 1. Сильні і слабкі електроліти. Ступінь і константа дисоціації. 2. Кислотно-основні індикатори. Універсальний індикатор. 3.Як визначити ступінь дисоціації? 4.Що таке константа дисоціації? Напишіть її вираз для карбонатної кислоти. 5.Закон розведення Оствальда. 6.Напишіть рівняння і константу дисоціації води. 7.Що таке йонний добуток води? 8.Що таке водневий показник розчину? 9.Які значення рН в кислих, лужних і нейтральних розчинах? 10.Що таке активність розчину? 11. Дайте визначення кислот і основ з точки зору протонної теорії. Приклад завдань для тестового контролю: 1. Що таке ацидоз? а) зміщення рН середовища в організмі у лужну сторону; б) розрідження крові внаслідок плазмолізу; в) зміщення рН середовища в організмі у кислу сторону; г) підвищене згортання крові. 2. Значення рН крові людини в нормі: а) 7,63; б) 7,36; в) 7,46; г) 7,56. 3. Розрахувати рОН розчину гідроксиду амонію з концентрацією 0,2 моль/л, якщо ступінь дисоціації α=0,042 а) 4,2; б) 2,08; в) 4,16; г) 3,06. 4. При розчиненні якої із солей середовище нейтральне: а) Na2CO3; б) NН4Cl; в) ВaCl2; г) CuSO4.
Поиск по сайту: |
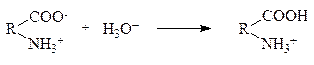
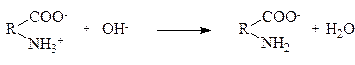
 ). Визначити рН даної системи. Як зміниться рН даного аміачного буферу при доливанні до нього 10 мл розчину кислоти з молярною концентрацією еквівалентів 0,2 моль/л.
). Визначити рН даної системи. Як зміниться рН даного аміачного буферу при доливанні до нього 10 мл розчину кислоти з молярною концентрацією еквівалентів 0,2 моль/л.
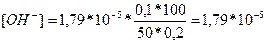
 , звідси
, звідси 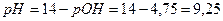
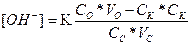
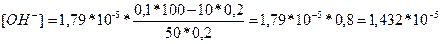

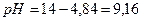
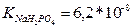 )
)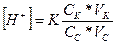 приймемо за VК=
приймемо за VК=  = х, а VC=
= х, а VC= 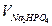 =100-x
=100-x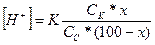 дасть
дасть