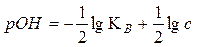|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Теорія кислот і основ
Теорія електролітичної дисоціації С.Арреніуса (1883), була першою науково обгрунтованою теорією розчинів, згідно з якою, кислотами є сполуки в розчинах яких присутні йони Н+, а основи – ОН-. Однак розвиток науки показав, що існують речовини, особливо лікарські речовини (фенобарбінтал, сульфадімезин), які проявляють кислотні властивості, а при дисоціації не утворюють вільних Н+. Крім того доведено, що у водних розчинах Н+ не бувають у вільному вигляді, а у вигляді йону: Н+ + Н2О = НзО+ Сучасні уявлення про природу кислот і основ дали Дж. Бренстед та І.Льюїс (1923р). Згідно їх теорії, яка називається протонною, кислота - це речовина, що віддає протон (донор протону), а основа - речовина, що приймає протон (акцептор протона). Так наприклад при взаємодії води з гіпохлоритною кислотою:
супряжена супряжена супряжена супряжена кислота основа основа кислота І II І II Кислоту і основу називають супряженою парою і кислотні властивості речовини можуть проявлятись тільки в присутності основи (акцептора протона), а основні властивості - в присутності кислоти (донора електронів). Такі погляди на кислоти і основи дали можливість систематизувати багато хімічних реакцій. В першу чергу - це реакції гідролізу і нейтралізації. Так процес гідролізу за Бренстедом пояснюється тим, що один із видів йонів цих солей підлягає протолізу: Наприклад гідроліз соди (натрій карбонату) електролітична дисоціація: Nа2СОз = 2 Nа+ + СОз2- протоліз аніону слабкої кислоти: СОз2- + Н2О = НСОз- + ОН- надлишок групи ОН- свідчить, що розчин буде лужним. Реакція нейтралізації по Бренстеду характеризується процесами: протоліз НС1+ Н2О = С1-+Н3О+ електролітична дисоціація NаОН = Nа+ + ОН- нейтралізація: Н3О+ + ОН- = 2Н2О Отже, згідно сучасних уявлень, кислота - це акцептор пари електронів, а основа - донор електронів. (теорія Льюїса)
Дисоціація води. Згідно з теорією Бренстеда вода відносно самої себе є одночасно і кислотою і основою (амфоліт) Н2О =ОН-+Н+ Н2О + Н+ = Н3О+ Н2О + Н2О = Н3О+ + ОН- ця реакція називається автопротолізом води: кількісно автопротоліз визначається йонним добутком води. Константи рівноваги К=3,24.10-18 при 290 К К=1,84 .10-16 при 273 К
Оскільки ступінь дисоціації води дуже низький (з 550 млн. молекул води -дисоціює тільки одна), то її концентрацію можна вважати постійною і рівною масі 1 л води при 25°С 998,07 г, поділеній на молярну масу води
Обчисливши скільки молей води є в 1 л її ( при 0°С)
можна розрахувати добуток концентрації [H3O+].[OH-]=K.[H2O]2 Отже рівняння [H3O+].[OH-]=1.10-14 йонний добуток води. Це величина постійна, яка все ж залежить від температури. Для прикладу при 100°С йонний добуток води зростає в 100 разів в порівнянні з тим, що при 18оС і стає 10-12. Йонний добуток води має надзвичайно важливе практичне значення. В нейтральному розчині коли [H3O+]=[OH-]= В кислому середовищі, коли [H3O+]>[OH-] можна сказати, що[H3O+]>10-7, а [OH-] <10-7 В лужному середовищі[H3O+]<10-7, а [OH-] >10-7 Те, що йонний добуток води є величина постійна дає можливість знаючи концентрацію одного з йонів обчислювати концентрацію іншого. Наприклад, якщо відомо що в розчині [Н3О+] = 10-3 моль/л, то це значить, що середовище розчину кисле, а концентрація [ ОН-] = Для зручності розрахунків реакцію середовища водного розчину характеризують водневим показником рН. Водневий показник рН - це десятковий логарифм активності йонів гідроксонію, взятий з від’ємним знаком.
pH=-lg[H3O+] Аналогічно рОН-= -lg[OH-] Оскільки активності йонів в чистій воді дорівнюють їх концентраціям, а= с, то можем записати, що рКводи=рН + рОН-=14 Наприклад, якщо відомо, що розчин НС1 має концентрацію 0,01 моль/л, і знаючи що це сильна кислота і дисоціює повністю на йони [ Н3О+] = c HCl і значить [Н3О+] = 10-2 моль/л, рН = 2, а pОН-= 14 - 2 = 12 Для розчину NаОН з См = 0,001 моль/л [ОН-] = 10-3, тобто pОН- = 3, а pН = 14 - 3 =11. Для Н2SO4 в якої молярна концентрація еквівалентів 0,002 моль/л рН=-lg2.10-3=3-lg 2=2,7 pOH=14-2,7=11,3 Для розчинів слабких кислот і основ, в яких кількість йонів значно менша за концентрацію кислоти чи основи треба знати значення ступеня або константи йонізації. рН=-lg c .α або згідно з законом Освальда де Ка - константа йонізації ( в "Довіднику хіміка"); с - концентрація. Аналогічно для слабких основ рОН=-lg c .α
Отже, для розчину СН3СООН з См =0.1 моль/л
Водневий показник рН використовується дуже широко при біохімічних дослідженнях, а також у клінічній фармакологічній практиці. Постійність концентрації водневих йонів є однією із істотних констант внутрішного середовища організму. При цьому відомо, що різні фізіологічні рідини людини мають різні значення рН
Це свідчить про те, що різні біологічні ферменти є активними тільки при певних значеннях рН. Зміщення реакції середовища в організмі в сторону кислого середовища називається ацидозом, а в сторону лужного - алкалозом. Зміна реакції крові на декілька десятих долей рН приводить до серйозних порушень життєдіяльності. Визначення концентрації водневих йонів дозволяє визначити характер патологічних процесів, що протікають в організмі. Визначення рН середовища має важливе значення і в різних фізіологічних рідинах може бути досить складним. Сучасний розвиток приладобудування дозволяє мати прилади, які визначають досить точно рН -розчину, що є важливим інструментом для медика.
Поиск по сайту: |
 НClО + Н2О СlO- + H3O+
НClО + Н2О СlO- + H3O+


 1,84.10-16.55,52= 1.10-14
1,84.10-16.55,52= 1.10-14 - ця величина постійна.
- ця величина постійна.
 або
або
 тоді
тоді