 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Приклади розв’язування задач за темою «Розчини»
Задача 1. У воді об'ємом 400 мл розчинили сіль масою 80 грам. Визначте відсоткову концентрацію солі в розчині. Розв’язок: 1. Визначимо масу води: m(Н2О)= V • С = 400 • 1 = 400(г). 2. Визначимо масу розчину: mрозчину= m(Н2О)+ mречовини = 400 + 80 = 480(г). 3. Розрахуємо відсоткову концентрацію солі в розчині: Задача 2. Скільки глюкози і води необхідно взяти для приготування 500 г 5% розчину для ін'єкцій. Розв’язок: 1. Знайдемо масу глюкози: 2. Знайдемо масу води: m (Н2О)= mрозчину – m(Н2О)= 500 – 25 = 475 г.
Задача 3.Яку масу хромату калію K2CrO4 потрібно узяти для приготування 1,2 л 0,1 М розчину? Розв’язок: m(K2CrO4) = С(K2CrO4) • V • M(K2CrO4)= 0,1 моль/л • 1,2 л • 194 г/моль 23,3 г. Відповідь: Таким чином, для приготування 1,2 л 0,1 М розчину потрібно взяти 23,3 г K2CrO4 і розчинити у воді, а об'єм довести до 1,2 літрів. Задача 4. Скільки хлороводню міститься в шлунковому соку об'ємом 2 літри, якщо молярна концентрація НCl в шлунковому соку дорівнює 0,1 М. Розв’язок: 1. Знайдемо молярну масу НCl: М(HCl)= 1 + 35,5 = 36,5 (г/моль) 2. Знайдемо масу НCl: m(HCl)= C•M•V = 0,1•36,5•2 = 7,3(г).
Задача 5. Визначити молярність розчину сірчаної кислоти з відсотковою концентрацією 9,8 % (ρ = 1,18 г/мл). Розв’язок: (1 спосіб) 1. Визначимо масу 1 літра розчину кислоти: m розчину =ρ • V = 1,18•1000=1180 г 2. Визначимо кількість молей кислоти в розчині: 3. Знайдемо кількість моль кислоти в 1 літрі розчину, тобто молярність розчину:
Розв’язок: (2 спосіб)
Задача 6.Розрахуйте молярну концентрацію і нормальність 70%-вого розчину H2SO4 (ρ = 1,615 г/мл). Розв’язок: Для обчислення молярності і нормальності треба знати число грамів H2SO4 в 1 л розчину. 70% -ний розчин H2SO4 містить 70 г H2SO4 в 100 г розчину. 1) Ця вагова кількість розчину займає об'єм 2) Отже, в 1 л розчину міститься: 3) Звідси, молярність даного розчину дорівнює: 4) Нормальність цього розчину (вважаючи, що кислота використовується в реакції як двоосновна) дорівнює: Приклад перерахунку концентрації розчину, вираженої в масових частках на молярну концентрацію. Яка молярна концентрація розчину питної соди, якщо його масова частка 2,5%, а густина 1,02 г/см3? Розв’язування задач здійснюється послідовною відповіддю на поставлені питання: 1) Що необхідно знайти? 2) Що дано в умові для цього? Питна сода - це гідрокарбонат натрію NaHCO3. Молярну концентрацію розчину визначють як кількість молів речовини в 1 л розчину Отже, для того, щоб розв’язати цю задачу необхідно визначити кількість молів розчину ν= В умові задачі дано, що ω=2,5 %. Якщо розчин має масову частку 2,5 %, то це означає, що в 100 г розчину міститься 2,5 г соди. Отже, можна прийняти, що m (NаНСОз) =2,5 г, а m розчину=100 г. Знайдемо кількість молів соди: M(NаНСОз) = 23+1+12+3.16= 84 г/моль ν = Знайдемо об’єм 100 г розчину використовуючи, що ρ= V= Отже, тепер можна визначити молярну концентрацію розчину: Задачу можна розрахувати іншим способом: Масова частка цього розчину:
Молярна концентрація цього розчину:
Знайшовши із рівності (1) m(NaHCO3) і підставивши її у рівність (2), одержимо:
Проведемо обчислення:
Заняття №5 Тема: Розчини. Виготовлення розчинів заданої масової і молярної концентрацій. Актуальність теми:Розчини відіграють дуже важливу роль у різних процесах, у тому числі у життєдіяльності організмів, у техніці і побуті. В медичній практиці розчини використовують для діагностики, лікування, заміни втраченої крові, для наукових досліджень. Використання розчинів різної концентрації в лікарській практиці вимагає знання способів вираження концентрацій розчинів і вміння приготувати розчини необхідної концентрації для практичного використання. Навчальні цілі: Знати: основні положення про розчини і способи визначення концентрації розчинів. Вміти: розрахувати необхідну кількість компонентів і приготувати розчини з заданою масовою часткою, молярною концентрацією та молярною концентрацією еквівалентів.
Поиск по сайту: |

 г
г (моль)
(моль)
 М.
М. М.
М. мл
мл г (H2SO4)
г (H2SO4) M (моль/л)
M (моль/л) H (моль-екв/л)
H (моль-екв/л)
 і об’єм розчину V.
і об’єм розчину V.
 =0,03 моль NаНСО3
=0,03 моль NаНСО3 звідки:
звідки: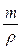 = 100 г : 1,02 г/см3 = 98,04 см3 = 0,098 л
= 100 г : 1,02 г/см3 = 98,04 см3 = 0,098 л
 (1)
(1) (2)
(2)

