 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Приборы и принадлежности: Лабораторная установка ФПТ 1-11
Установка ФПТ 1-11 состоит из двух основных частей: 1)Приборный блок; 2)Рабочий элемент.
Измерение температуры производится цифровым контроллером c пределом измерения около 3000С, с помощью которого производится запись температуры в зависимости от времени T = f(t). Теплота плавления металла определяется методом наблюдений средних скоростей охлаждения металла до и после кристаллизации. Теплоту плавления металла вычисляют по графику зависимости температуры остывающего (или нагревающегося) металла от времени, получаемого экспериментально. Аналогичный график представлен на рис.4. Участок AB соответствует остыванию жидкого металла, участок CD – охлаждению твердого металла. Энтропия интересная и необычная функция состояния термодинамической системы, это понятие непосредственно связано со вторым началом термодинамики. Энтропией называется функция состояния “S”, дифференциал которой в элементарном обратимом процессе равен отношению бесконечно малого количества теплоты dQ, сообщённого системе, к температуре, при которой этот переход произошёл: Однако все реальные процессы в природе необратимы. Для необратимых процессов изменение энтропии Рассмотрим процесс плавления металла. Процесс передачи тепла является необратимым, поэтому выражение второго начала термодинамики следует использовать в форме Пусть тигель с металлом приведён в контакт с нагревателем (тепло передаётся от более нагретого тела при температуре Т1 к менее нагретому телу – металлу с температурой Т2, причём Т1>Т2). Тогда количество теплоты Оценим это приращение количественно,
где с, m – теплоёмкость и масса металла, Тпл – температура плавления металла, Т1 – комнатная температура, l - удельная теплота плавления металла. Тогда
Физический смысл понятия “энтропия” был раскрыт Больцманом в выражении S=klnW, где k – постоянная Больцмана, W – количество микросостояний, соответствующих данному макросостоянию системы (стат. вес). Согласно этой интерпретации понятие энтропии связывается с более привычными понятиями “порядок” и “беспорядок”. Энтропию системы можно рассматривать как количественную меру беспорядка в системе. При этом второе начало термодинамики звучит так: “естественные процессы стремятся перевести систему в состояние с большим беспорядком”. Когда металл при плавлении превращается в жидкость, энтропия жидкого металла увеличивается. В твёрдом состоянии его структура более упорядочена, чем в жидком, где он может растекаться, т. е. упорядоченное расположение металла в кристаллической решётке сменилось неупорядоченным, в известной мере, случайным движением молекул в жидком состоянии. Таким образом, процессы плавления металла сопровождаются приращением энтропии.
Поиск по сайту: |
 На лицевой панели приборного блока расположены органы управления и регулирования установки, цифровой контроллер для измерения времени, амперметр и вольтметр. Рабочий элемент представляет собой коробчатый конструктив, укрепленный на стойке. Спереди он закрыт экраном из оргстекла. На передней панели закреплен кронштейн, на котором установлен стакан с исследуемым материалом – оловом. В стакане размещены нагреватель и датчик температуры. Нагреватель выполнен из нихромовой спирали, заключенной в кожух из кварцевого стекла.
На лицевой панели приборного блока расположены органы управления и регулирования установки, цифровой контроллер для измерения времени, амперметр и вольтметр. Рабочий элемент представляет собой коробчатый конструктив, укрепленный на стойке. Спереди он закрыт экраном из оргстекла. На передней панели закреплен кронштейн, на котором установлен стакан с исследуемым материалом – оловом. В стакане размещены нагреватель и датчик температуры. Нагреватель выполнен из нихромовой спирали, заключенной в кожух из кварцевого стекла. .
. , т. е. при переходе системы из одного состояния в другое энтропия всегда возрастает. Каких-либо исключений из этого правила не обнаружено. Поэтому обобщённая формулировка второго начала термодинамики читается так: “полная энтропия произвольной системы вместе с её окружением в любых естественных процессах увеличивается, т. е. DS>0.
, т. е. при переходе системы из одного состояния в другое энтропия всегда возрастает. Каких-либо исключений из этого правила не обнаружено. Поэтому обобщённая формулировка второго начала термодинамики читается так: “полная энтропия произвольной системы вместе с её окружением в любых естественных процессах увеличивается, т. е. DS>0. . Как же тогда вычислить величину приращения энтропии
. Как же тогда вычислить величину приращения энтропии  для реального необратимого процесса – плавления металла? Энтропия является функцией состояния, поэтому для оценки DS можно использовать выражение для какого-либо обратимого процесса, т. к. когда тела вошли в тепловой контакт, то начальное и конечное состояния каждого тела одинаковы.
для реального необратимого процесса – плавления металла? Энтропия является функцией состояния, поэтому для оценки DS можно использовать выражение для какого-либо обратимого процесса, т. к. когда тела вошли в тепловой контакт, то начальное и конечное состояния каждого тела одинаковы. , взятое у более нагретого тела – тигля, приведёт к уменьшению его энтропии на
, взятое у более нагретого тела – тигля, приведёт к уменьшению его энтропии на  ; т. к. T1>T2, то DS>0. Таким образом, энтропия одного тела уменьшается, а другого увеличивается, но полное изменение энтропии является положительным.
; т. к. T1>T2, то DS>0. Таким образом, энтропия одного тела уменьшается, а другого увеличивается, но полное изменение энтропии является положительным.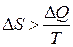 (1)
(1)


 .
.