 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Порядок выполнения работы. Для определения коэффициента внутреннего трения используются шарики
Желательно расположить прибор так, чтобы глаз наблюдателя находился на уровне верхней метки. При опускании шарика в жидкость необходимо учесть, что: 1) траектория его движения должна проходить как можно ближе к оси цилиндра, 2) движение шарика в жидкости должно начинаться с нулевой начальной скоростью. Прежде чем включать секундомер, необходимо выждать установления равномерной скорости движения шарика. В момент прохождения шарика мимо верхней метки включают секундомер; в момент прохождения шарика через нижнюю метку – выключают. Считая движение шарика между метками равномерным, получают скорость его движения Измерение диаметра шариков нужно производить непосредственно перед опусканием каждого из них в жидкость, во избежание несоответствия в результатах скорости шариков их диаметрам. Примечание. Во время опыта цилиндр с исследуемой жидкостью должен быть хорошо освещен, но лампу не следует ставить близко к сосуду во избежание нагрева исследуемой жидкости. Результаты экспериментальных измерений и расчетов по формуле (22) занести в таблицу 2: Таблица 2
Оценить погрешность эксперимента. Контрольные вопросы 1. В чем заключается явление внутреннего трения в жидкости? 2. Что понимается под коэффициентами кинематической и динамической вязкости жидкостей? 3. Как изменяется коэффициент вязкости от температуры? 4. Какое движение жидкости называется ламинарным? 5. Какие силы действуют на шарик, движущийся в жидкости? 6. Какая кривая называется реологической, каков ее смысл? 7. Какие жидкости называются ньютоновскими? 8. Преобразовав путем разделения переменных и интегрированием формулу 3, проанализировать зависимость скорости слоев жидкости от координаты z. Лабораторная работа № 2-5 ИЗУЧЕНИЕ ФАЗОВЫХ ПЕРЕХОДОВ ПЕРВОГО РОДА Цель работы: Изучение явления фазового перехода первого рода. Задача работы: Определение температуры и удельной теплоты плавления металлов, оценка приращения энтропии в ходе фазового перехода. Теория
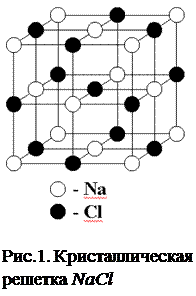
Фазовые переходы бывают двух типов - первого и второго рода. К фазовым переходам первого рода относятся изменение агрегатного состояния вещества: процессы плавления и кристаллизации, испарения и конденсации, сублимации или возгонки [1], при этом скачком изменяется плотность, внутренняя энергия, энтропия. Следует заметить, что твердым считается кристаллическое состояние, т.е. состояние в котором атомы располагаются в узлах кристаллической решетки. На рис.1 изображена кристаллическая решетка каменной соли NaCl . Как видно из рисунка, кристалл, благодаря пространственной периодичности структуры, состоит как бы из повторяющихся частей. В кристалле размером 1 мм повторяющееся расположение атомов встречается сотни тысяч раз. Поэтому к такому расположению атомов применяется термин “дальний порядок”. Большинство твердых тел – являются кристаллическими телами. В обычных условиях они состоят из сросшихся зерен размером порядка 0,001 мм. В таком зернышке отчетливо выражен дальний порядок. Однако в природе встречаются твердые вещества со сложным молекулярным строением, например, стекла, смолы, пластики, которые не имеют периодической структуры. Это аморфные твердые тела, которые на самом деле являются жидкостями с аномально большой вязкостью. Такие тела приобретают свойство текучести не скачком, а путём постепенного уменьшения вязкости, которое вызывается повышением температуры. Аморфные твердые тела противопоставляются кристаллам, которые имеют форму правильного многогранника. Следует подчеркнуть, что кристалличность не обязательно проявляется в особенностях их внешней формы, это структура решетки (кусок металла не имеет правильной формы, но не является аморфным). Каков же основной признак кристаллов? Этим признаком является наличие резко выраженной температуры плавления. Если подводить тепло к кристаллическому телу, то температура его будет повышаться до тех пор, пока не начнёт плавиться. После чего подъем температуры прекратится, и весь процесс плавления будет происходить при строго определённой постоянной температуре, называемой температурой плавления
В аморфных телах при повышении температуры характер расположения атомов не меняется, увеличивается их подвижность, атомы с увеличением температуры “выскальзывают” из своего окружения, меняя соседей. Наконец, число таких перемен в секунду становится таким же большим как для жидкости. Выше мы говорили, что при всех агрегатных превращениях поглощается или выделяется энергия. Например, для превращения килограмма воды в пар необходимо затратить энергию 2,3×106 Дж. Эта энергия необходима для преодоления сил притяжения, действующих между молекулами воды.
К числу фазовых превращений первого рода относятся и некоторые переходы твердого тела из одной кристаллической модификации в другую. Эти превращения называются полиморфными. Кристаллы различной модификации состоят из одного и того же вещества, и отличаются друг от друга лишь строением кристаллической решетки. Например, графит и алмаз состоят из одного и того же элемента – углерода. Разные структуры означают и разные физические свойства. Алмаз по физическим свойствам очень не похож на графит. Графит имеет черный цвет, он совершенно непрозрачен, алмаз же прозрачен и бесцветен; графит не горит даже при очень высоких температурах (он плавится при 385 °С), алмаз же в струе кислорода сгорает при 720 °С. Другой пример – белое и серое олово. Белое олово – блестящий, легкий и очень пластичный металл, серое олово – хрупкое и легко превращается в порошок.
Поиск по сайту: |
 Для определения коэффициента внутреннего трения используются шарики, диаметр которых определяется микрометром.
Для определения коэффициента внутреннего трения используются шарики, диаметр которых определяется микрометром. . Внутренний радиус цилиндрического сосуда
. Внутренний радиус цилиндрического сосуда  определяют штангенциркулем, опыт с разными шариками повторяют 10 раз.
определяют штангенциркулем, опыт с разными шариками повторяют 10 раз.





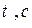

 Испарение жидкости или плавление твердого тела относится к категории процессов, которые называются в физике фазовыми переходами или превращениями. Состояния вещества, между которыми происходит фазовый переход, называется его фазами. Характерной особенностью этих переходов является их скачкообразность. Например, при охлаждении воды ниже комнатной температуры, её тепловое состояние меняется постепенным образом, понижение температуры на десять-пятнадцать градусов к каким-либо видимым изменениям не приводит, и вдруг, при охлаждении на ничтожную долю градуса, вода переходит в совершенно иное состояние, состояние льда. Вода и лёд – две фазы одного и того же вещества.
Испарение жидкости или плавление твердого тела относится к категории процессов, которые называются в физике фазовыми переходами или превращениями. Состояния вещества, между которыми происходит фазовый переход, называется его фазами. Характерной особенностью этих переходов является их скачкообразность. Например, при охлаждении воды ниже комнатной температуры, её тепловое состояние меняется постепенным образом, понижение температуры на десять-пятнадцать градусов к каким-либо видимым изменениям не приводит, и вдруг, при охлаждении на ничтожную долю градуса, вода переходит в совершенно иное состояние, состояние льда. Вода и лёд – две фазы одного и того же вещества. Тпл.
Тпл. На рис.2 изображены схемы строения кварца и кварцевого стекла. Одно и тоже в химическом отношении вещество, но одно в кристаллическом, другое в аморфном виде. Характер окружения ближайшими соседями в обоих случаях одинаков, но в аморфном теле отсутствует дальний порядок; аморфное тело – это “испорченный кристалл”. Отсутствие дальнего порядка, характерного признака кристаллических тел, является непосредственной причиной отсутствия выраженной точки плавления. В точке плавления совершается переход, при котором дальний порядок исчезает и решетка распадается на легкоподвижные субмикроскопические области, имеющие то же расположение атомов, что и исходный кристалл, но статически беспорядочно ориентированные друг относительно друга, остаётся лишь ближний порядок в расположении атомов.
На рис.2 изображены схемы строения кварца и кварцевого стекла. Одно и тоже в химическом отношении вещество, но одно в кристаллическом, другое в аморфном виде. Характер окружения ближайшими соседями в обоих случаях одинаков, но в аморфном теле отсутствует дальний порядок; аморфное тело – это “испорченный кристалл”. Отсутствие дальнего порядка, характерного признака кристаллических тел, является непосредственной причиной отсутствия выраженной точки плавления. В точке плавления совершается переход, при котором дальний порядок исчезает и решетка распадается на легкоподвижные субмикроскопические области, имеющие то же расположение атомов, что и исходный кристалл, но статически беспорядочно ориентированные друг относительно друга, остаётся лишь ближний порядок в расположении атомов. Металлы начинают плавиться только тогда, когда начинает разрушаться их кристаллическая решетка, на что также необходимо затрачивать энергию. Эта энергия называется скрытой теплотой плавления. Теплота плавления, отнесённая к массе вещества, называется удельной скрытой теплотой плавления. Например, для цинка она составляет 1.11×105 Дж./кг, т.е. нужно количество теплоты 111 кДж./кг, чтобы при Тпл =419.5°С перевести 1 кг цинка из твердого состояния в жидкое. На рис.3 представлена кривая фазового перехода твердого тела – жидкость (1). Обратное превращение – кристаллизация (2) происходит при той же температуре и сопровождается поглощением того же количества энергии, что и при плавлении – скрытой теплоты кристаллизации. Скрытой теплота перехода называется потому, что подвод (поглощение) и отвод (выделение) этой теплоты не сопровождается таким эффектом, как повышение и понижение температуры. Несмотря на то, что мы продолжаем нагревать тело (кривая правления 1), во время плавления температура не повышается, так же во время кристаллизации (кривая кристаллизации 2) температура не понижается, хотя мы продолжаем охлаждать жидкость. Переход жидкость - твердое тело сопровождается выделением энергии. Энергия взаимодействия микроскопических кристаллов становится значительно выше энергии тепловых колебаний, жидкость кристаллизуется. Однако новая фаза при таком переходе образуется не сразу во всем объеме, сначала образуются зародыши ее, которые затем растут, распространяясь на весь объем.
Металлы начинают плавиться только тогда, когда начинает разрушаться их кристаллическая решетка, на что также необходимо затрачивать энергию. Эта энергия называется скрытой теплотой плавления. Теплота плавления, отнесённая к массе вещества, называется удельной скрытой теплотой плавления. Например, для цинка она составляет 1.11×105 Дж./кг, т.е. нужно количество теплоты 111 кДж./кг, чтобы при Тпл =419.5°С перевести 1 кг цинка из твердого состояния в жидкое. На рис.3 представлена кривая фазового перехода твердого тела – жидкость (1). Обратное превращение – кристаллизация (2) происходит при той же температуре и сопровождается поглощением того же количества энергии, что и при плавлении – скрытой теплоты кристаллизации. Скрытой теплота перехода называется потому, что подвод (поглощение) и отвод (выделение) этой теплоты не сопровождается таким эффектом, как повышение и понижение температуры. Несмотря на то, что мы продолжаем нагревать тело (кривая правления 1), во время плавления температура не повышается, так же во время кристаллизации (кривая кристаллизации 2) температура не понижается, хотя мы продолжаем охлаждать жидкость. Переход жидкость - твердое тело сопровождается выделением энергии. Энергия взаимодействия микроскопических кристаллов становится значительно выше энергии тепловых колебаний, жидкость кристаллизуется. Однако новая фаза при таком переходе образуется не сразу во всем объеме, сначала образуются зародыши ее, которые затем растут, распространяясь на весь объем.