 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Йодометрия: принцип метода, стандартные растворы, их приготовление и стандартизация, индикаторы и практическое применение.
Йодометрический метод анализа основывается на окислительно-восстановительных процессах, связанных с восстановлением І2 до І-–ионов или окислением І-–ионов до І2: І2 + 2е Û 2І-. Кристаллический йод малорастворим в воде. Поэтому часто в качестве стандартного применяют его раствор в КІ. При растворении І2 в КІ образуются ионы [І3]-:
І2 + І- Û [І3]-. Нормальный ох-red потенциал системы І2 / 2І- ( Как видим, ох-red потенциал этой системы не зависит от концентрации ионов гидрогена, если реакция проводится в кислой среде. Однако, большинство веществ, содержащих в своем составе атом оксигена, вступают в реакции с [І3]- или І-, образуя в присутствии ионов гидрогена молекулы воды: H2AsO4- + 2І- + 3H+ Û HAsO2 + 2H2O + І2. (А) Поэтому окислительно-восстановительные потенциалы таких систем сильно зависят от рН. В кислых растворах ох-red потенциал системы H2AsO4- / HAsO2 сильно увеличивается в сравнении с потенциалом системы [І3]-/3 І-:
По мере уменьшения концентрации ионов гидрогена уже в слабокислых и нейтральных, а особенно в щелочных растворах HAsO2 + 2H2O + І2 Û H3AsO4 + 2І- + 2H+. (В) Таким образом, прохождение реакции А или В очень зависит от рН. Главным веществом восстановителем, применяемым в йодометрии, является натрий тиосульфат, который реагирует с йодом по уравнению:
2S2O32- + І2 Û S4O62- + 2І-. Na2S2O3 используют для титрования избытка йода, который добавляется в процессе титрования некоторых восстановителей, или йода, который образуется при взаимодействии йодидов с окислителями, например: Cl2 + 2І- Û 2Cl- + І2. Положение пары І2 / 2І- приблизительно по середине таблицы окислительных потенциалов показывает, что: а) существует ряд восстановителей, способных окисляться свободным йодом (Е0<0,54); б) есть также ряд окислителей, которые могут восстанавливаться йодид-ионами (Е0>0,54). Отсюда возникает возможность двойного использования окислительно-восстановительных свойств пары І2 / 2І- в титриметрии: а) для определения восстановителей окислением раствором йода; б) для определения окислителей восстановлением йодид ионами. Определение восстановителей: SO32- + I2 + H2O = SO42- + 2I- + 2H+; AsO2- + I2 + 2H2O = HAsO42- + 2I- + 3H+; H2S + I2 = S¯ + 2I- + 2H+; Sn2+ + I2 = Sn4+ + 2I-. Определение окислителей: Cr2O72- + 6I- + 14H+ = 3I2 + 2Cr3+ + 7H2O; I2 + Na2S2O3 = 2NaI + Na2S4O6. Br2 + 2I- = I2 + 2Br-; 2MnO4- + 10I- + 16H+ = 5I2 + 2Mn2+ + 8H2O; ClO3- + 6I- + 6H+ = 3I2 + Cl- + 3H2O; 2NO2- + 2I- + 4H+ = I2 + 2NO + 2H2O; H2O2 + 2I- + 2H+ = I2 + 2H2O; 2Fe3+ + 2I- = I2 +2Fe2+. Определение кислот: IO3- + 5I- + 6H+ = 3I2 + 3H2O. Чувствительность йодкрохмальной реакции 10-6-10-5 н І2 при условии присутствия избытка І-. Методы титрования: прямое, непрямое и обратное.
Преимущество йодометрии: 1. Применяется для большинства веществ, которые даже не реагируют ни с І2 ни с І- (определение воды по Фишеру): I2 + SO2 + H2O + CH3OH + C5H5N = C5H5NHSO2OCH3 + 2C5H5NH+ + 2I-. Реактив Фишера (I2 + SO2 + C5H5N) в CH3OH. 2. Наивысшая точность среди всех ох-red методов. 3. В отсутствии окрашенных веществ можно титровать без индикатора (5*10-5 н І3- заметен в растворе). 4. І2 хорошо растворяется в органических растворителях, поэтому возможны неводные растворы йода для разнообразных йодометрических определений.
Недостатки йодометрии: 1. Летучесть І2, поэтому потери при определении (необходимо добавлять большой избыток КІ, закрывать банку пробкой, смоченной КІ и т.д.) 2. Окисление І- в кислых растворах кислородом воздуха (йодометрическое титрование необходимо проводить при небольшой кислотности растворов) 3. Нельзя применять щелочную среду: І2 + 2ОН- = ІО- + І- + Н2О. 4. Потенциал пары І2 / 2І- небольшой, поэтому много йодометрических реакций обратимы и до конца не проходят (специальные условия). 5. Скорость реакции между определяемым окислителем и І- -ионами не большая, поэтому к титрованию йода, который выделился, приступают только через некоторое время. 6. Адсорбция элементарного йода осадками, которые образовались: Сu2+ + 3І- = CuI¯ + І2. CuI:І2. 7. Изменение титров стандартных растворов І2 и Na2S2O3 в процессе хранения и использования. 8. Порядок сливания нельзя нарушать.
Приготовление растворов: А) Na2S2O3 - готовят приблизительной концентрации; - добавляют Na2СO3 0,1 г на 1 л раствора; - стандартизацию проводят через 10 дней после приготовления раствора S2O32- + Н2О + СО2 = НСО3- + НSO3- + S¯. - 2Na2S2O3 + О2 = 2Na2SO4 + 2 S¯. - разложение тиобактериями. Б) раствор І2: - І2 + КІ. В) раствор крахмала. 1% (добавляют HgI2 как стабилизатор). Стандартизация Na2S2O3 поК2Cr2O7 (методом пипетирования или отдельных навесок). К2Cr2O7 + КІ + Н2SO4 = К2SO4 + Cr2(SO4)3 + І2 + Н2О. I2 + Na2S2O3 = 2NaI + Na2S4O6. Стандартизация I2 по Na2S2O3.
Поиск по сайту: |


 = +0,5345 В), а системы [І3]-/3 І- (
= +0,5345 В), а системы [І3]-/3 І- ( 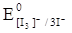 = +0,5355 В), то есть можно считать практическим равным.
= +0,5355 В), то есть можно считать практическим равным.
 и поэтому [І3]- окисляет HAsO2 в H3AsO4:
и поэтому [І3]- окисляет HAsO2 в H3AsO4:
