 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Кривые редоксиметрических титрований.
При окислительно-восстановительном титровании в растворе протекают реакции: Ох1 + n1e = Red1, Ох2 + n2e = Red2. Любой участник этих полуреакций может быть, как титрантом, так и веществом, которое титруют. Так если титрант - вещество Ох1, то титруемое вещество Red2; если титрант Ох2, то оттитровывают вещество – Red1. И наоборот, если в качестве титрантов выступают Red1 или Red2, то оттитровывают вещества Ох2 и Ох1 соответственно. Для каждой полуреакции в соответствии с уравнением Нернста (влияние µ=0, ƒ ±=1):
При титровании между титрантом и титруемым веществом проходит реакция: Ох1 + Red2 = Ох2 + Red1. После добавления каждой порции титранта в растворе устанавливается равновесие. Система приобретает потенциал Е, который зависит от соотношения концентраций исходных веществ и продуктов. Поэтому логично в качестве изменяемого параметра при построении кривых титрования использовать потенциал системы. При равновесии потенциалы полуреакций равны Е = Е1 = Е2 поэтому для расчета Е необходимо использовать и уравнение для Е1 и Е2. При выборе уравнений руководствуются соображениями удобства и простоты расчетов. До точки эквивалентности удобно пользоваться уравнением для полуреакций с участием вещества, которое оттитровывают, после точки эквивалентности – уравнением для полуреакций с участием титранта. На самом деле, до точки эквивалентности весь добавленный титрант превращается в сопряженную форму, поэтому для расчета потенциала сначала необходимо рассчитать константу равновесия реакции, чтобы найти равновесную концентрацию титранта. Расчет упрощается, если пользоваться полуреакцией с участием вещества, которое оттировывают, поскольку [Ох] и [Red] и ее форм рассчитать легко: количество сопряженной формы титруемого вещества равно количеству добавленного титранта. После точки эквивалентности картина обратная: все вещество, которое оттитровывается переходит в сопряженную форму и равновесная концентрация исходной формы очень мала. Чтобы рассчитать ее, снова необходима константа равновесия реакции. Поэтому удобнее использовать полуреакцию с участием титранта, концентрации окисленной и восстановленной форм которого найти легко: в результате титрования образуется столько же сопряженной формы титранта, сколько вещества которое оттитровали, находилось в исходном растворе. При построении кривых окислительно-восстановительного титрования потенциал системы до начала титрования не рассчитывают, поскольку в исходном растворе известна концентрация только одной из сопряженных форм вещества, которое титруют. В точке эквивалентности: пусть вещество, которое оттитровывают, восстановитель, тогда:
где f – процент оттитрованного вещества. Если титруют окислитель, то:
После точки эквивалентности: если титруют восстановитель, а титрант - окислитель, то:
В случае, если титрант восстановитель, то:
В точке эквивалентности расчеты потенциала вести неудобно ни по полуреакции титранта, ни по полуреакции титруемого вещества, поскольку в обоих случаях концентрация одной из сопряженных форм очень мала. Во избежание громоздких расчетов с использованием константы равновесия (хотя это и возможно), используют следующий прием. Записывают уравнения Нернста в точке эквивалентности для каждой полуреакции:
Прибавляют оба уравнения, предварительно умножив их на n1 и n2 соответственно:
Под знаком логарифма находятся концентрации реагирующих веществ в точке эквивалентности. По условию стехиометричности в точке эквивалентности: [Ох1] = [Red1], а [Ох2] = [Red2], тогда:
Таким образом,
Во все уравнения для расчета потенциала Е входят величины стандартных потенциалов. Если в процессе титрования возможно протекание конкурирующей реакции или невозможно пренебречь ионной силой, то стандартные потенциалы следует заменить формальными. На величину скачка титрования на кривой окислительно-восстановительного титрования влияет ряд факторов: 1) природа титруемого вещества и титранта. Чем больше разность их стандартных потенциалов, тем больше скачок титрования; 2) величина рН. Если в полуреакциях окисления-восстановления принимают участие ионы водорода, то их концентрация входит в уравнение Нернста, и, соответственно, влияет на величину скачка титрования. В таком случае вместо стандартного потенциала используют формальный (реальный):
где z – стехиометрический коэффициент при Н+-ионах в уравнении окислительно-восстановительной реакции. Пример 1. Построить кривую титрования 100,00 мл 0,1000 н раствора сульфата железа (ІІ) 0,1000 н раствором сульфата церия (IV) в 1 М H2SO4. В справочниках находят формальные потенциалы пар К точке эквивалентности:
В точке эквивалентности:
После точки эквивалентности:
Заполняют таблицу. Значение Е при титровании 0,1000 н раствора сульфата железа (ІІ) сульфатом церия (IV) в 1 М H2SO4.
Пример 2. Построить кривую титрования 100 мл 0,1 н Fe2+ 0,1 н KMnО4 в 2 н растворе H2SO4 ([Н+]=1 моль/л). Титруют восстановитель раствором окислителя: 5Fe2+ + MnО4- + 8H+ = 5Fe3+ + Mn2+ +4H2O.
До точки эквивалентности: В точке эквивалентности:
После точки эквивалентности:
Заполняют таблицу: Изменение величины окислительно-восстановительного потенциала при титровании 100 мл раствора FeSO4 раствором KMnО4 такой же нормальности ([Н+]=1 моль/л).
Точка эквивалентности не лежит на линии скачка, так в этой реакции стехиометрические коэффициенты равны 1 и 5. Кривые редоксиметрического титрования, в общем, имеют такой же вид, как и кривые титрования в методе осаждения и кислотно-оновного титрования. Возле точки эквивалентности здесь тоже наблюдается резкий скачок потенциала, а другие участки кривой идут полого, что еще раз подтверждает незначительное влияние изменения концентрации на потенциал пары. Наличие скачка на кривой титрования можно использовать для точной фиксации точки эквивалентности с помощью индикаторов. В то же время, кривые редоксиметрического титрования обычно не зависят от разбавления раствора, поскольку в уравнение Нернста входит соотношение концентраций окисленной и восстановленной форм, которое с разбавлением раствора не изменяется. Все это справедливо только тогда, когда стехиометрические коэффициенты для окисленной и восстановленной форм в каждой из пар одинаковы. Иначе степени, в которые возводят концентрации ионов, находящиеся в числителе и знаменателе дроби под знаком логарифма, будут различными. Вследствие этого с разбавлением раствора, как эта дробь, так и потенциал раствора Е будут изменяться. Действительно, в этом случае числитель и знаменатель дроби, стоящей под знаком логарифма, придется возводить в разные степени, и потому изменение концентраций при разбавлении раствора скажется на величине потенциала. Так, при бихроматометрическом определении Fe (II) при титровании происходит реакция: Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ +6Fe3+ +7H2O. Окислительно-восстановительный потенциал пары Cr2O72-/2Cr3+ выражается формулой:
Если раствор разбавить вдвое, то отношение
Поиск по сайту: |




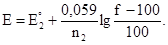

 /n1
/n1 /n2
/n2
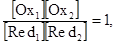 поэтому:
поэтому: 


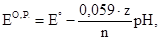


 Титруемое вещество - восстановитель, а титрант – окислитель.
Титруемое вещество - восстановитель, а титрант – окислитель.










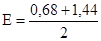
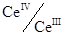



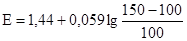




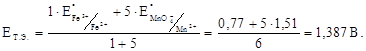




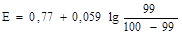






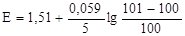

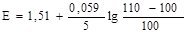




 не останется неизменным, а возрастет в два раза. Кроме того, на потенциал сильно будет влиять снижение концентрации Н+. Влияние последнего обстоятельства следует учитывать и во всех других случаях, когда Н+-ионы участвуют в реакции титрования. Независимость кривой титрования от концентраций будет здесь наблюдаться лишь при условии, если величина [H+] поддерживается практически постоянной.
не останется неизменным, а возрастет в два раза. Кроме того, на потенциал сильно будет влиять снижение концентрации Н+. Влияние последнего обстоятельства следует учитывать и во всех других случаях, когда Н+-ионы участвуют в реакции титрования. Независимость кривой титрования от концентраций будет здесь наблюдаться лишь при условии, если величина [H+] поддерживается практически постоянной.