 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Перманганатометрия: принцип метода, стандартные растворы, их приготовление и стандартизация, практическое применение.
Перманганатометрия – это метод, базирующийся на применении перманганата калия в качестве титранта для определения восстановителей. Главным стандартным раствором окислителя в перманганатометрии является раствор переманганата калия (КМnО4). Титрование стандартным раствором перманганатом калия проводят в кислой среде. Перманганат калия, как окислитель в объемном анализе, был предложен в 1846 году Ф. Маргиритом для титрования солей Fe (II). Принципиальную схему окислительно-восстановительного процесса при участии перманганата калия можно представить следующим способом: MnO4- + 8H+ + 5e = Mn2+ + 4H2O Окислительно-восстановительний потенциал данной системы изображается уравнением:
где Из этого уравнения видно, что MnO4- + 2H2O + 3e = MnО2 + 4ОН-
где таким образом, потенциал окислительно-восстановительной пары Приготовление раствора перманганата калия. а) расчет и взятие навески.
При расчете эквивалентной массы перманганата калия необходимо учитывать, что количество реагента, которое расходуется на окисление определяемого вещества, зависит от реакции среды, в которой происходит титрование. - в кислой среде - в щелочной и нейтральной среде Пусть необходимо приготовить 1 л 0,05 н раствора КМnО4 для титрования в кислой среде, то:
Перманганат калия всегда содержит примеси продуктов восстановления, например, MnО2. Кроме того, он легко разлагается при действии восстановителей – аммиака, органических веществ, которые оказываются в воде с пылью и т.д. Вследствие этого концентрация раствора КМnО4 через некоторое время после приготовления несколько уменьшается. Отсюда выплывает, что приготовить титрованный раствор перманганата калия по точной навеске невозможно. Титр его необходимо устанавливать не раньше, чем через 7-10 дней после приготовления раствора. За это время окисление всех присутствующих в растворе восстановителей успеет закончиться, и титр КМnО4 перестает изменяться. Если раствор перманганата калия прокипятить, то скорость окисление восстановителей увеличивается, и всю операцию приготовления раствора можно закончить за 1-2 часа. Для того, чтобы раствор КМnО4 был достаточно устойчивым и титр его не изменялся, осадок МnО2, присутствующий в нем в качестве примеси и как вещество, которое образовалось в результате окисления перманганатом калия органических веществ и аммиака, содержащиеся в воде, необходимо отделить, так как он катализирует разложение КМnО4. Необходимо также помнить, что перманганат калия окисляет резину, пробковое дерево, бумагу и другие вещества, потому что необходимо избегать контакта раствора с ними. Так, нельзя фильтровать раствор КМnО4 через бумажные фильтры, а необходимо использовать стеклянный фильтрующий тигель. Сохранять раствор КМnО4 необходимо в темной посуде
в темноте, так как при действии света ускоряется процесс разложения КМnО4: МnО4- + 2Н2О = 4МnО2¯ + 4ОН- + 3О2. На технических весах грубо взвешивают массу навески и растворяют в воде объемом, измеренным мерным цилиндром. Через некоторое время стандартизируют. Очень часто стандартный раствор КМnО4 готовят из его раствора, который долго сохранялся в лаборатории путем разбавления. Этот метод приготовления стандартного раствора имеет свои преимущества: 1. Раствор готовится быстро, не содержит примесей, которые окисляются, не содержит осадка оксида марганца (IV); 2. Приготовленный раствор нет необходимости кипятить или много дней отстаивать, как это рекомендуется при приготовлении раствора по навеске КМnО4; 3. Исключается необходимость взятия навески, растворения и отделения осадка МnО2. б) стандартизация раствора КМnО4. Существуют самые разнообразные методы установления титриметрических характеристик стандартного раствора перманганата калия, базирующиеся на использовании самых разнообразных веществ. Чаще всего применяются свежеперекристаллизованные Н2С2О4*2Н2О, оксалат натрия, высушенный при 105-110 °С в течении 2 часов в сушильном шкафу либо оксалат аммония, который кристаллизуется с одной молекулой воды (NН4)2С2О4*Н2О. Применяют также и другие стандартизированные вещества: соль Мора (NH4)2[Fe(SO4)2]*6Н2О, гексацианоферат (ІІ) калия K4[Fe(CN)6]*3Н2О, металлическое железо, As2O3 (особо чистый). Оксалат аммония имеет преимущества перед другими стандартными веществами: 1. хорошо кристаллизируется. 2. Соответствует определенному химическому составу. 3. Не содержит примесей при перекристаллизации. 4. Относительно легко растворяется в воде. 5. Не взаимодействует с углекислым газом и кислородом воздуха. Используя Н2С2О4*2Н2О можно стандартизировать раствор КМnО4 двумя способами: методом отдельных навесок и методом пипетирования. в) конечная точка титрования. Установление конечной точки титрования выполняется безиндикаторным (по окрашиванию избытка перманганат-ионов), потенциометрическим или амперометрическим методами. Перманганатометрическим методом можно определять ряд восстановителей: H2O2, NO2-, C2O42-, Fe2+ и др., Ca2+ в разных препаратах, MnO2, PbO2, K2Cr2O7, персульфаты и другие окислители методом обратного титрования (сначала их восстанавливают до соединений в низших степенях окисления). Восстановители: металлы (Fe, Bi, Ag, Cd, Zn, редкоземельные элементы), неметаллы (Sb, As, P и др.), ионы низших степеней окисления, которые могут давать соединения высших степеней окисления (Fe2+, Cr3+, Mn2+, Sn2+, Cu+, Ti3+, VIII, VIV, MoIII, UIV, WIV, AsIII и др.), ионы неметаллов типа Cl-, Br-, I-, S2- и т.д., комплексные анионы-восстановители (SO32-, SeO32-, TeO32-,S2O32-, SCN-, CN-, NO2-, [Fe(CN)6]4-), поли- и оксикарбоновые кислоты (HOOCCOOH), альдегиды, формиатную, мочевую, аскорбиновую, сульфаниловую кислоты, сахариды, полифенолы, ненасыщенные соединения и много других продуктов. Окислители: Fe3+, CeIV, VV, UVI, MoVI, WVI, CrVI, MnO2, PbO2, NO3-, BrO3-, ClO3-, IO3-, S2O32- и др. Титрование перманганатом можно осуществлять прямым, обратным и непрямым методом. Прямым титрованием определяют много восстановителей, которые легко и без потерь окисляются перманганатом. Обратное титрование часто применяют для определения восстановителей, которые окисляются перманганатом медленно, и окислителей, которые предварительно восстанавливаются соответствующими восстановителями до соединений низших степеней окисления. Для определения большинства веществ, которые не окисляются перманганатом в строго эквивалентных количественных соотношениях, и для которых невозможно применение метода обратного титрования, применяют непрямые методы.
Преимущества перманганатометрии: 1. Возможность фиксации конечной точки титрования по исчезновению или возникновению малинового окрашивания. 2. Возможность использования кислой или щелочной среды. 3. Высокий 4. Дешевый и доступный реагент. 5. Возможность определения веществ, которые не имеют окислительно-восстановительных свойств.
Недостатки перманганатометрии: 1. Относительное загрязнение реагента (MnO2), поэтому перманганат всегда вторичный стандарт, для определения концентрации которого необходимо стандартное вещество или фиксанал. 2. Неустойчивость стандартного раствора. 3. Нежелательность использования метода в присутствии хлорид-иона, невозможность подкисления растворов с помощью хлоридной кислоты. 4. Часто необходимо нагревание, потому что скорость реакции довольно низкая. 5. Достижение равновесия и т.д. зависит от множества факторов, поэтому необходимо очень четко придерживаться условий, описанных в методике.
Поиск по сайту: |

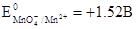
 очень зависит от величины рН. Иногда титрование стандартным раствором перманганатом калия проводят в нейтральном или щелочном растворах. Схему этой реакции можно представить уравнением:
очень зависит от величины рН. Иногда титрование стандартным раствором перманганатом калия проводят в нейтральном или щелочном растворах. Схему этой реакции можно представить уравнением:

 очень сильно зависит от [ОН-] или [Н+].
очень сильно зависит от [ОН-] или [Н+].



 ;
;  ;
;  ;
; 


 и
и  .
.