 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Теплотворная способность некоторых лесных горючих материалов.
Древесина содержит около 42% собственного кислорода. Предварительное окисление делает углеводородную молекулу непрочной. Такая молекула может распадаться при относительно низких температурах подогрева. В процессе распада она выделяет летучие вещества, которые при смешивании с воздухом начинают гореть пламенем. Поэтому древесина относится к сравнительно легко загораемым материалам. На рис.45 изображена схема процесса горения древесины от подогрева до угольной фазы.
Рис.45. Схема процесса горения древесины. В зависимости от повышения температуры установлены следующие стадии горения: при 00 <t< 1000 - процесс нагревания; при 1000 <t< 1500 - испарение влаги; при 1500 <t< 3000 - нарастающий процесс разложения древесины с выделением горючих газов; при 3200 <t< 5000- постепенное замедление процесса разложения внутри обугленной частицы; при 5000 <t< 10000 - горение углей с выделением СО и СО2. По мере удаления из частиц летучих веществ светящееся пламя начинает спадать и наконец, исчезает совсем. Таким образом, древесина не горит с поверхности, а разлагается с нее. Горит топливный газ. В конце процесса горения остаются углеродные частицы, окруженные полупрозрачным синеватым пламенем окиси углерода воздуха. В результате интенсивного окисления кислородом воздуха углеродные частицы быстро сгорают и превращаются в золу. Важной характеристикой процесса горения различных веществ является расход воздуха, обеспечивающий горение. Объем воздуха V0, м3, необходимый для сжигания 1 кг горючего вещества можно оценить следующим образом. Если горючее вещество определяется формулой СаНbОcNd количество кислорода, обеспечивающее сгорание 1 грамм-моля (или 1 килогромм-моля) вещества находится по уравнению (7.1), в данном случае это (а+b/4-c/2)О2. Разделив полученную величину на массу 1 моля горючего вещества, можно найти количество кислорода, требуемого для сгорания единицы массы рассматриваемого вещества
где m0 – масса кислорода в граммах, если сжигается 1 грамм горючего вещества, и в килограммах, если сжигается 1 килограмм вещества; значения a, b, c, d имеют тот же смысл, что и в формуле (7.1). Известно, что воздух состоит из смеси газов, при этом кислород составляет 21% (по объему). Известно, также, что 1 грамм-моль и 1 килограмм-моль любого газа при нормальных условиях занимают объем 22,4 дм3 и 22,4 м3 соответственно. Следовательно, газообразный кислород массой m0, кг, занимает объем V*, м3
где О2 – масса 1 килограмма – моля кислорода. Объем воздуха, V0, м3, обеспечивающий сгорание 1 кг горючего вещества, определяется соотношением
Пример. Определить расход воздуха, требуемый для сжигания 1 кг клетчатки (С6H10O5), являющейся основой древесины. Решение.1. Используя уравнение (7.1) составляем реакцию горения клетчатки в атмосфере кислорода, принимая значение a=6, b=10, c=5, d=0.
Количество кислорода, необходимое для сжилания 1 килограмм – моля клетчатки, сотавляет
2. По соотношению (7.2) находим количество кислорода, требуемое для сжигания 1 кг клетчатки
3. Находим объем газообразного кислорода массой m0=1,185 кг
4.Находим расход воздуха при сжигании 1 кг клетчатки
При необходимости учета влажности горючих материалов, а также при горении веществ, определяемых более сложной химической формулой, для оценок расхода воздуха при горении можно воспользоваться рекомендациями [53].
Поиск по сайту: |

 (7.2)
(7.2) ,
, ,
, ,
,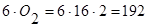 кг
кг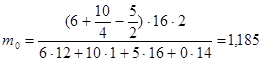 кг
кг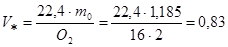 м3
м3 м3
м3