 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Некоторые сведения о горении. Горючие материалы в лесу.
Пожар-это неконтролируемый процесс горения. Принято считать, что горение - химическая реакция, сопровождающаяся выделением тепла и света [52] . С этой точки зрения вещества могут “гореть “ не только в кислороде. Например, некоторые металлы “горят” в хлоре, окислы натрия и бария ”горят” в углекислом газе. Тем не менее, в общепринятом понимании горение- это быстро протекающая реакция соединения горючего вещества с кислородом воздуха, сопровождающая выделением тепла и излучением света. Таким образом, горение есть не что иное, как окислительная реакция, сопровождающаяся образованием новых веществ и выделением избыточной теплоты, накопленной в молекулах горючего вещества. Следует отметить, что горение различных горючих материалов может начаться либо в результате воспламенения от внешнего источника тепла, либо при самовоспламенении. Температура самовоспламенения для различных веществ различна. Например, для торфа она составляет ~4200. Причиной самовоспламенения торфа являются биологические и химические процессы, возникающие при определенной влажности и относительно низкой температуре. Способностью к самовозгоранию на открытом воздухе обладают также сено, опилки, подстилка, листья, собранные в большие кучи и имеющие определенную влажность. Однако лесные пожары, как отмечалось выше, чаще возникают при неосторожном обращении с огнем. Воспламенение (зажигание) отличается от самовоспламенения тем, что при воспламенении часть горючего вещества нагревается тепловым источником, привнесенным из вне, тогда как при самовоспламенении повышение температуры происходит за счет внутренней энергии самого горючего вещества. Эти понятия важны при понимании причин возникновения лесных пожаров[54]. Как отмечалось, при горении выделяется большое количество тепла. Теплотой сгорания вещества называется количество теплоты, которое выделяется при сгорании единицы массы (1 кг.) вещества в атмосфере кислорода. Пусть, например, требуется определить теплоту сгорания горючего вещества СаНbОcNd , где индексы а, b, с, d обозначают количество атомов углерода, водорода, кислорода, азота в молекуле этого вещества, по известной формуле его сгорания в атмосфере кислорода [55]. СaНbОcNd+(а+b/4-c/2)О2=аСО2+ Где СаНbОcNd – горючее вещество; О2 – окислитель; СO2, H2O, N2 – продукты сгорания; Qcr – теплота сгорания. Для определения теплоты сгорания Qcr необходимо знать энергию образования веществ СaНbОcNd, О2, CO2, H2O, N2. Теплотой (энергией) образования называется тепловой эффект, получающийся при образовании одного грамм-моля данного вещества из свободных элементов в стандартных условиях, то есть при температуре 250 и давлении 1 атм. Существует несколько способов расчета теплоты образования. Один из наиболее распространенных способов основывается на использовании принципа аддитивности энергий связи в молекулах. Каждой связи отвечает определенная энергия, а сумма энергий связи приближенно равна энергии образования моля вещества из атомов. Теплоту образования определяют по термохимическим таблицам[56]. Следует отметить, что теплота образования простых веществ (O2,H2,N2 ,С и др.) принимается равной нулю. Данные по теплоте образования некоторых веществ приведены в табл.31 Таблица 31
Поиск по сайту: |
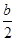 H2O+
H2O+ 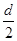 N2+Qcr, (7.1)
N2+Qcr, (7.1)