 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Физико-химические основы процесса горения
Горение топлива представляет собой сложный процесс химических реакций быстрого окисления горючих, приводящий к выделению тепла и резкому росту температуры реагентов, участвующих в процессе. Сложным процесс горения является потому, что условия его возникновения и характер протекания связаны с целым рядом таких явлений, как теплообмен, диффузия и др., которые в большой степени влияют на ход и результаты горения, особенно в условиях промышленного сжигания топлива. Современная теория горения разработана в значительной мере Н.Н.Семеновым, Г.Ф.Кнорре, А.С.Предводителевым и другими. В условиях производства строительных материалов и изделий твердое топливо может сжигаться по-разному -кусками в плотном слое; -в кипящем или во взвешенном слое; - в виде пыли; -запрессованным в обжигаемом материале; -между изделиями; Горение твёрдого топлива, когда горючее и окислитель находятся в различных агрегатных состояниях и окисление происходит на поверхности их раздела, относится к гетерогенному виду горения. Горение газообразного топлива относится к гомогенному типу горения. Жидкое топливо перед сжиганием распыливается на мельчайшие капли, что в громадной степени увеличивает поверхность горючего, т.к. температура кипения жидкого топлива меньше, чем его температура воспламенения, то капельки топлива быстро испаряются и горение жидкого топлива происходит по гомогенному типу горения. При недостатке же окислителя жидкие топлива распадаются с выделением большого количества частичек твёрдого углерода, который обусловливает при высоких температурах яркую светимость пламени. Исследованиями Н.Н.Семенова было показано, что горение представляет собой цепную реакцию с разветвляющимися цепями, когда каждая активная молекула порождает несколько новых активных центров, что приводит к воспламенению и сгоранию в короткое время. Например: горение водорода описывается общим стехиометрическим уравнением вида 2H В действительности, реакция идет следующим образом: молекула водорода сталкивается с какой-либо активной молекулой М: H Это приводит к разрушению связей и образованию высоко-активного атомарного водорода. Цепная реакция с разветвляющимися цепями приводит к возникновению новых активных центров O, OH, H, а так же H
Не устойчивые промежуточные продукты реакции являются активизаторами быстрого разветвления и завершения реакции. Реакции с разветвляющимися цепями характеризуются некоторым периодом, когда тепловой эффект перед воспламенением незаметен, т.к. основная доля энергии расходуется на создание активных центров. Этот период носит название период индукции. При повышении температуры этот период сокращается. Важнейшим вопросом подготовки процесса горения и его ускорения является вопрос о смешении горючего и окислителя. Он имеет большое практическое значение в производственных условиях. Скорость химической реакции горения будет наивысшей только при быстром подводе окислителя в достаточном количестве, немедленном отводе продуктов горения и при высокой температуре. В противном случае она будет замедленна. Общая продолжительность горения τ слагается из времени, необходимого для подвода окислителя и завершения молекулярной диффузии горючего и окислителя перед их горением τ τ = τ В зависимости от соотношения величин τ -кинетическую τ -диффузионную τ -промежуточную τ При низких температурах и давлениях реакция окисления горючего протекает медленно, влияние τ -повышение температуры; -повышение концентрации активных реагентов; -повышение давления среды; При высоких температурах реакция окисления происходит настолько быстро, что общее время горения зависит уже от скорости подвода окислителя к горючему и от полноты контакта с ним. Горение при этом переходит в диффузионную область. Если константа скорости реакции горения в сильной степени зависит от температуры, то коэффициент массообмена при диффузии от нее мало зависит. Таким образом, в диффузионной области, аэродинамические факторы и условия смешения горючего и окислителя становится решающим. Воспламенение горючей смеси хорошо объясняется теорией «теплового взрыва», разработанной Н.Н.Семеновым. При горении в замкнутом объеме выделяющиеся тепло Q
Рис. 1. Тепловыделение при горении топлива Тепловыделение Q Это явление названо «тепловым взрывом», а критическая температура в точке 3 - температурой воспламенения. Как видно из вышесказанного, температура воспламенения зависит от многих факторов, поэтому нельзя считать эту температуру постоянной физико - химической характеристикой топлива. Более высокую температуру воспламенения имеют топлива, характеризующиеся меньшим содержанием летучих Лг. Температура воспламенения зависит от концентрации горючих и давления смеси. При росте концентрации температура воспламенения вначале понижается, что объясняется относительным уменьшением количества газов, не участвующих в реакции и тепла, идущего на их нагрев. Когда же количество горючего превысит некоторый предел и количество окислителя окажется уже недостаточным для полного окисления топлива, то скорость реакции замедлится и температура воспламенения повысится. При увеличении давления температура воспламенения понизится.
Поиск по сайту: |
 + O
+ O  2H
2H 
 , и времени, необходимого для подвода окислителя и завершения молекулярной диффузии горючего и окислителя перед их горением τ
, и времени, необходимого для подвода окислителя и завершения молекулярной диффузии горючего и окислителя перед их горением τ  .
. идет как на повышение температуры сгорания, так и на отдачу во внешнюю среду Q
идет как на повышение температуры сгорания, так и на отдачу во внешнюю среду Q 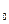 .
.
 (рис.1) при повышении температуры возрастает пропорционально комплексу е
(рис.1) при повышении температуры возрастает пропорционально комплексу е  , в то время как кривая зависимости теплоотдачи во внешнюю среду Q0 имеет значительно меньшую кривизну. Точки 1, 2 и 3 пересечения кривых Qв и Q0 соответствуют равенству прихода и расхода тепла Qв = Q0 и равновесию системы. Однако характер равновесия в каждой из них различен. Равновесие устойчиво только в точке 1, где происходит процесс медленного окисления горючего. Точка 2 характеризует неустойчивое равновесие. Если температура системы несколько повысится, то тепловыделение Qв начнет резко превышать теплоотдачу Q0 (по линии А), что приведет к росту температуры, т.е. к дальнейшему нарушению равновесия. При первом же небольшом охлаждении ниже Т2 тепловыделение начнет быстро отставать от теплоотдачи, что приведет к падению температуры, пока не установится устойчивое равновесие в точке 1. Если теплоотдача идет по кривой С, то тепловыделение избыточно, температура высока и топливо горит. Касание в точке 3 кривых Qв и Q0 (режим теплоотдачи по линии В) характеризует критическое состояние системы, когда после постепенного повышения температуры в точке 3 процесс резко переходит в стадию прогрессирующего превышения тепловыделения над теплоотдачей.
, в то время как кривая зависимости теплоотдачи во внешнюю среду Q0 имеет значительно меньшую кривизну. Точки 1, 2 и 3 пересечения кривых Qв и Q0 соответствуют равенству прихода и расхода тепла Qв = Q0 и равновесию системы. Однако характер равновесия в каждой из них различен. Равновесие устойчиво только в точке 1, где происходит процесс медленного окисления горючего. Точка 2 характеризует неустойчивое равновесие. Если температура системы несколько повысится, то тепловыделение Qв начнет резко превышать теплоотдачу Q0 (по линии А), что приведет к росту температуры, т.е. к дальнейшему нарушению равновесия. При первом же небольшом охлаждении ниже Т2 тепловыделение начнет быстро отставать от теплоотдачи, что приведет к падению температуры, пока не установится устойчивое равновесие в точке 1. Если теплоотдача идет по кривой С, то тепловыделение избыточно, температура высока и топливо горит. Касание в точке 3 кривых Qв и Q0 (режим теплоотдачи по линии В) характеризует критическое состояние системы, когда после постепенного повышения температуры в точке 3 процесс резко переходит в стадию прогрессирующего превышения тепловыделения над теплоотдачей.