 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
НОМЕНКЛАТУРА. ІЗОМЕРІЯ. За номенклатурними правилами ШРАС назви ароматичних діазосполук утворюють шляхом
За номенклатурними правилами ШРАС назви ароматичних діазосполук утворюють шляхом додавання до назви вихідного вуглеводню суфікса -діазо-, а назви солей діазонію — додаванням закінчення -діазоній з подальшою вказівкою аніона: Глава 21
бензендіазогідроксид; дІазогідрат
4-хлоробензендіазощанід +
4-метилбензендіазошй бромід Йоганн Петер ГРИСС (1829-1888) Німецький хімік-органік. Основні наукові праці належать до хімії нітрогеновмісних органічних сполук. Уперше одержав (1857) діазосполуки і запропонував термін «діазо». Відкрив реакцію діазотування ароматичних амінів нітритною кислотою в середовищі мінеральної кислоти. Запропонував (1864) спосіб відновлення діазосполук. Одержав (1864) новий тип барвників — азобарвники. Відкрив барвники, що використовуються для фарбування бавовни.
натрій бензендіазотат Ковалентнопобудовані діазосполуки можуть існувати у вигляді двох геометричних ізомерів — син-(цис-) і анти-(транс-), з яких більш стійкою є анти-форма (див. с. 84):
X
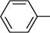
ашли-діазосполука СПОСОБИ ДОБУВАННЯ СОЛЕЙ АРЕНДІАЗОНІЮ реакція діазотування.Реакція, відкрита 1858 року німецьким хіміком йоганном Петером Гриссом, ґрунтується на взаємодії первинних ароматичних амінів з нітритною кислотою в середовищі сильної мінеральної кислоти, найчастіше хлоридної або сульфатної. Оскільки сама нітритна кислота надто нестійка, зазвичай на практиці ароматичний амін обробляють розчином солі нітритної кислоти (NaNO2, KNO2) у присутності сильної мінеральної кислоти, причому на 1 моль аміну використовують не менше 2,5 моль мінеральної кислоти: 1 моль — на одержання нітритної кислоти, один — на утворення солі діазонію, а надлишок кислоти необхідний для створення кислого середовища. Мінеральна кислота бере також участь у розчиненні ароматичного аміну, однак у реакцію діазотування вступає не сіль аміну, а вільний амін, який у невеликій кількості знаходиться в рівновазі з нею: с6н5— с6н5-кн2 + на Реакція діазотування екзотермічна. Оскільки солі діазонію при нагріванні легко розкладаються, діазотування проводять при температурі 0...-5°С:
; НС1 (надлиш.)
Н2О бензендіазоній хлорид ДІаЗО- та аЗОСПОЛУКи
Механізм реакції. При взаємодії натрій нітриту з мінеральною кислотою утворюється нітритна кислота, яка в кислому середовищі утворює кілька діазотуючих + + агентів — протоновану нітритну кислоту Н— О—К= , нітрозоній-катіон N= О
і нітроген(III) оксид н Н—б—N=0 Н+ —N=0 Н—О—N=0 :«= протонована нітритна кислота 0=N—6—N=0 Н2О + N=0 нітрозоній-катіон
Н 5 н нітроген(Ш) оксид Найактивнішим серед утворених діазотуючих агентів є нітрозоній-катіон. Спочатку він атакує атом Нітрогену ароматичного аміну з утворенням N-нітрозаміну, який у кислому середовищі легко переходить у свою таутомерну форму — ді-азогідроксид. Потім діазогідроксид у кислому середовищі перетворюється в сіль діазонію: С6Н5— N=0 Н С6Н5—її—N=0 ГІ ^ Н5+ С6Н5—N^-N=0)" ІЧ-нітрозамш
С6Н5—М=И—ОН діазогідроксид сіль діазонію Н—О—Н Унаслідок реакції одержують водні розчини солей діазонію, які безпосередньо використовують для подальших реакцій. Взаємодія первинних ароматичних амінів з алкілнітритами.При дії на первинні ароматичні аміни естерів нітритної кислоти в присутності мінеральної кислоти в середовищі етанолу утворюються солі діазонію в кристалічному вигляді:
+ С2Н5— О— N=0+ НС1 ----------------»- етилнітрит С6Н5—N=N0 бензендіазоній хлорид + С2Н5—ОН+ Н2О Використання солей діазонію в кристалічній формі обмежене через їх високу вибухонебезпечність. ФІЗИЧНІ ВЛАСТИВОСТІ Солі діазонію — безбарвні кристалічні речовини, легко розчиняються у воді. Вони нестабільні, при нагріванні і механічній дії розкладаються з вибухом. Тому в реакціях зазвичай використовують їх свіжоприготовані водні розчини. Глава 21 306Г ХІМІЧНІ ВЛАСТИВОСТІ Реакційна здатність солей діазонію зумовлена наявністю в їх структурі ді-азокатіона. Методом рентгеноструктурного аналізу встановлено, що атоми Нітрогену в діазокатіоні розміщені лінійно в площині бензенового кільця. Зв'язок між атомами Нітрогену за довжиною відповідає потрійному (0,11 нм). це свідчить про те, що обидва атоми Нітрогену перебувають у стані sp-гібридизації. При цьому один з них містить позитивний заряд, а інший — має неподілену пару електронів (формула I). Позитивний заряд катіона делокалізований в основному між атомами Нітрогену та лише частково за рахунок я-електронної системи бензенового кільця (формула II):
8+ II. У результаті делокалізації кожний з атомів Нітрогену набуває часткового позитивного заряду, що можна зобразити за допомогою резонансних структур:
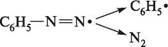
Реакції за участі солей діазонію можна умовно розділити на дві групи: з виділенням азоту і без виділення азоту. РЕАКЦІЇ З ВИДІЛЕННЯМ АЗОТУ Реакції солей діазонію з виділенням азоту супроводжуються розривом зв'язку С—N у діазокатіоні і заміщенням діазогрупи на інші атоми або групи атомів. Залежно від способу розриву зв'язку C—N заміщення діазогрупи може відбуватися за механізмом SN1 або SR. Механізм SN1 — це двостадійний процес. На першій, повільній, стадії відбувається гетеролітичний розрив зв'язку C—N у діазокатіоні з утворенням дуже нестійкого арил-катіону і молекули азоту. На другій стадії арил-катіон швидко взаємодіє з нуклеофілом, утворюючи продукт заміщення: Аг-К=№С арил-катіон Аг+ + Ш- —™^ Аг-№і Перебігу реакцій за механізмом SN1 сприяють нагрівання і розчинники, які мають високу сольватуючу здатність. Заміщення діазогрупи за радикальним механізмом відбувається в присутності каталізатора — солей Купруму(I) або порошкоподібної міді. Останні здатні виступати як донор електронів. На першій стадії реакції іон Cu+ віддає один електрон діазокатіону, перетворюючись в іон Cu2+. При цьому в діазокатіоні відбувається гомолітичний розрив зв'язку C—N з утворенням арильного радикала і молекули азоту. На другій стадії арильний радикал відриває атом галогену від купрум(II) галогеніду, регенеруючи тим самим купрум(I) галогенід: ДІаЗО- та аЗОСПОЛУКи
С6Н5—N= _ СиСІ
+ • і »Си—СІ С6Н5—СІ + СиСІ Реакції солей діазонію з виділенням азоту дозволяють ввести в ароматичне ядро різні замісники: —OH, —F, —Cl, —Br, —I, — C3N, — NO2, —OR тощо.
Заміщення діазогрупи на гідроксильну групу.Для заміщення діазогрупи на гідроксильну групу підкислені водні розчини солей діазонію піддають кип'ятінню. При цьому виділяється азот і утворюються феноли. Реакцію можна проводити з розчинами будь-яких солей, але краще з цією метою використовувати гідросульфати. Взаємодія відбувається за механізмом
С6Н5—К=КН8О4 бензендіазоній гідросульфат Щоб запобігти реакції азосполучення (див. с. 309) між сіллю діазонію і фенолом, який утворюється, зазвичай розчин солі діазонію додають поступово до киплячої розведеної сульфатної кислоти H2SO4. Заміщення діазогрупи на атом Йоду.При нагріванні розчинів солей діазонію з розчином натрій або калій йодиду діазогрупа заміщується на атом йоду. Реакція — один з найзручніших методів уведення йоду в ароматичне ядро: і
С6Н5— N=N0" бензендіазоній хлорид Заміщення діазогрупи, каталізоване солями Купруму(І) (реакція Зандмейєра). При каталітичній дії солей Купруму(І) діазогрупа може бути заміщена на атоми Хлору, Брому, нітрогрупу, ціаногрупу, хлоросульфонільну групу —SO2Cl тощо. Реакція названа на честь швейцарського хіміка Траугота Зандмейєра, який 1884 року із солей діазонію в присутності солей Купруму(І) одержав хлор- і бромарени. Реакція перебігає за механізмом SR:
сиси^ СН—СІ + N 65 2 хлоробензен С6Н5—Вг + N2+ КС1 бромобензен
І бензонітрил С6Н5—N02 + N2+ КС1 нітробензен С6Н5—8О2С1 + N2 бензенсульфохлорид Заміщення діазогрупи на атом Гідрогену.При нагріванні солей діазонію з відновлюючими агентами (гіпофосфітна кислота H3PO2, формальдегід, спирти тощо) Глава 21
Поиск по сайту: |

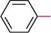

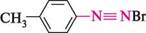
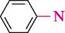
 0-5 °С
0-5 °С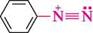
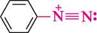
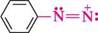
 -СиС12
-СиС12