 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
ГІДрОКСиЛЬнІ ПОхІДнІ ВУГЛеВОДнІВ. етери. із хлоридною — значно важче
сн3—сн2—он Механізм SN1: СН3 сн3—с—он сн3 2-метші-2-пропанол ІҐ
сн3— сн2- оксонієвий катіон СН3 тт Вг- С - б Н Н н перехідний стан СН, сн3—с—о сн3 оксонієвий катіон сн3 СН3-С+
сн карбокатіон Вг~ -Н,О
швидко Вг~ Вг—СН2—СН3 брометан сн3 СН3— С — Вг сн3 2-бром-2-метилпропан Взаємодія з галогенідами фосфору і галогенангідридами неорганічних кислот.При
дії на спирти галогенідів фосфору PCl3, PBr3, PCl5, тіонілхлориду SOCl2 утворюються галогеналкани:
ЗС2Н5—Вг с2н5—сі + росі3 + неї С2Н5—СІ + 5О2!+ НСі! Реакція з тіонілхлоридом відбувається за механізмом внутрішньомолекулярно-го нуклеофільного заміщення SN1, який включає стадію утворення естеру:
СН3-СН2-ОН+5ОС12 Т10Н1Л- хлорид етиловий естер хлорангідриду сульфітної кислоти сн3— сн2— сі хлоретан Глава 22 328Г Окиснення.Первинні, вторинні і третинні спирти по-різному реагують на дію окисників. Первинні спирти при окисненні спочатку утворюють альдегіди, які можуть окиснюватися далі, перетворюючись при цьому в карбонові кислоти: сн3—сн2—сн2—он н он 1-пропанол пропаналь пропанова кислота Вторинні спирти при окисненні утворюють кетони: СН,— СН—СН, он о 2-пропанол пропанон; ацетон Третинні спирти стійкі до окиснення, проте за жорстких умов вони окис-нюються з розривом вуглецевого скелета молекули й утворенням суміші кетонів та карбонових кислот. як окисники для окиснювання спиртів використовують хром(VI) оксид, калій дихромат у сульфатній кислоті (хромова суміш), калій перманганат у сульфатній кислоті тощо. У промисловості для окиснення первинних спиртів в альдегіди застосовують метод каталітичного дегідрування. Суть методу полягає в пропусканні парів спирту над каталізатором (тонкоздрібнена мідь) при 280—300°С. Відбувається відщеплення молекули водню від молекули спирту і утворюється альдегід. Перевагою каталітичного дегідрування є те, що не відбувається більш глибоке окиснення альдегіду до кислоти: к-сн2-он За умовами цієї реакції з вторинних спиртів синтезують також багато кетонів. ІДЕНТИФІКАЦІЯ СПИРТІВ хімічні методи.Для спиртів не існує якісної реакції, яка б переконливо і однозначно вказувала на наявність у молекулі гідроксильної групи. Спирти можна розрізнити за їх реакцією окиснення хромовим ангідридом CrО3 у водному розчині сульфатної кислоти. Приблизно упродовж двох секунд прозорий оранжевий розчин перетворюється на каламутний блакитнувато-зелений. Проте цієї реакції не дають третинні спирти. ця реакція характерна також для альдегідів, але їх можна відрізнити від спиртів іншими специфічними реакціями (див. c. 379, 381, 388). Реакція утворення естерш КСООК', які зазвичай мають характерний приємний запах, також може слугувати для ідентифікації спиртів. Первинні, вторинні і третинні спирти можна ідентифікувати за допомогою проби Лукаса. Проба ґрунтується на різній швидкості взаємодії первинних, вторинних і третинних спиртів з розчином цинк хлориду в концентрованій хлоридній кислоті (реактив лукаса). У результаті утворюється галогенопохідна вуглеводню, яка виділяється у вигляді дрібнодисперсного осаду. Взаємодіючи з реактивом лу-
Н Спирти, що мають у молекулі фрагмент —С — , дають позитивну йодо- ОН формну пробу. Вона полягає в обробці спирту йодом і натрій гідроксидом або натрій гіпойодитом Н К—С —СН3 + ШОІ —► К — С — СН3 + ШІ + Н2О (окиснення) ОН О К— С—СН3 + ЗІ2 + 3№ОН —► К— С —СІ3 + ЗИаІ + ЗНОН (галогену К—С —СІ3 + №ОН —► СНІ3| + К—С^ (розщеплення) г\ жовтий Унаслідок реакції утворюється жовтий осад йодоформу CHI3, що має характерний запах. йодоформна проба не строго специфічна реакція на спирти. Позитивну йодоформну пробу також дають ацетальдегід, метилкетони (див. с. 386), |3-дикетони, оксими, вінілові етери тощо.
Метиловий і етиловий спирти практично неможливо відрізнити за запахом. Уживання метилового спирту всередину може спричинити безповоротну втрату зору, дихальну недостатність, судоми і смерть. Антидотом, який видається, на перший погляд, дивним, є етиловий спирт. як відомо, метаболізм спиртів відбувається переважно в печінці. Фермент алкогольде-гідрогеназа каталізує перетворення спиртів у відповідні альдегіди. При отруєнні метанолом в організмі утворюється формальдегід, що, реагуючи з білками, і викликає вищезгадані симптоми. .О „тт глхл адкогольдегідрогеназа ^ _^ сн3— он — ► н—с н Сам метанол безпечний, але вживання його всередину може стати фатальним! Необхідно якнайшвидше ввести внутрішньовенно потерпілому етанол для того, щоб він успішніше конкурував за фермент алкогольдегідрогеназу. Спорідненість алкогольдегідрогенази з етанолом порівняно з метанолом у 25 разів вища! Необхідно задіяти фермент у реакцію окиснення етанолу з утворенням менш токсичного (але токсичного!) ацетальдегіду. сн3-сн2-он н це дає організму час вивести метанол без його окиснення в потенційно смертельно небезпечний формальдегід. Глава 22 Фізичні методи.Спирти, у молекулі яких відсутні хромофори, не поглинають ультрафіолетове світло з довжиною хвилі більше 200 нм. електронні спектри ненасичених і ароматичних спиртів характеризуються поглинанням за рахунок вуглеводневого радикала. Тому для аналізу спиртів електронна спектроскопія використовується дуже рідко. В інфрачервоних спектрах найбільш характерна інтенсивна широка смуга в ділянці 3600—3200 см~:, обумовлена валентними коливаннями групи O—H. Розширення цієї смуги відбувається внаслідок утворення міжмолекулярних водневих зв'язків. При відсутності водневих зв'язків (розведений розчин спирту в неполярному розчиннику CCl4) в ІЧ-спектрах спиртів спостерігається вузька смуга в ділянці 3640—3610 см~:. Інша інтенсивна широка смуга, викликана валентними коливаннями зв'язку C—O, розташована в ділянці 1200—1000 см~:. У ПМР-спектрах спиртів сигнал протона гідроксильної групи зазвичай виявляється в ділянці 2,0—5,0 млн"1. Величина хімічного зсуву залежить від ступеня асоціації і міцності водневих зв'язків. При зменшенні ступеня асоціації, наприклад, при розведенні спирту тетрахлорометаном, сигнал протона OH-групи зміщується в більш сильне поле. Відповідно до цього розміщення сигналу гідроксильної групи сильно залежить від температури, концентрації і природи розчинника. якщо в ІЧ-спектрах спостерігаються смуги, зумовлені як коливаннями водневозв'язаних, так і вільних гідроксильних груп, то в ПМР-спектрах спиртів спостерігається лише один сигнал. це пов'язано з тим, що для реєстрації ПМР-спектра необхідно більше часу, ніж для ІЧ-спектра. Тому фіксується лише один усереднений сигнал протонів OH-групи. При знятті ПМР-спектрів у диметилсульф-оксиді обмін протонами сповільнюється за рахунок виникнення сильних водневих зв'язків між розчинником і спиртом. це дозволяє спостерігати розщеплення сигналу гідроксильного протона за рахунок спін-спінової взаємодії із сусідніми протонами і, таким чином, за мультиплетністю сигналу встановлювати належність до первинних (триплет), вторинних (дублет) або третинних (синглет) спиртів.
Поиск по сайту: |
 Н+
Н+
 -н,о
-н,о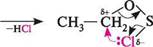
 ГІДрОКСиЛЬнІ ПОхІДнІ ВУГЛеВОДнІВ. етери
ГІДрОКСиЛЬнІ ПОхІДнІ ВУГЛеВОДнІВ. етери каса, третинні спирти виявляються майже одразу, вторинні — приблизно за 5 хв, а первинні спирти при кімнатній температурі практично не реагують.
каса, третинні спирти виявляються майже одразу, вторинні — приблизно за 5 хв, а первинні спирти при кімнатній температурі практично не реагують.
 незвичайний антидот
незвичайний антидот