 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Фізичні характеристики алкіламінів
Аміни утворюють менш міцні асоціати, ніж відповідні спирти, у зв'язку з тим, що електронегативність атома Нітрогену менша, ніж атома Оксигену. Третинні аміни не мають атома Гідрогену при атомі Нітрогену, тому вони не здатні до асоціації. Просторова модель молекули алкіламіну має форму чотиригранної піраміди, у вершині якої знаходиться атом Нітрогену. Валентні кути між зв'язками в середньому становлять 107—108°, тобто близькі до тетраедричного. Умовно прийнявши неподілену пару електронів атома Нітрогену за четвертий замісник, можна показати конфігурацію атома Нітрогену в амінах аналогічно тетраедричній конфігурації атома Карбону:
Виходячи з вищенаведеного, атом Нітрогену в амінах знаходиться в sp3 -гібридизації, а неподілена пара електронів займає sp3-гібридну орбіталь. Така будова припускає існування оптичної ізомерії в сполук, що мають три різних замісники при атомі Нітрогену (роль четвертого замісника виконує неподілена пара електронів). Однак, унаслідок інверсії, тобто швидкого взаємного амІни перетворення однієї тетраедричної конфігурації в іншу, розділити оптичні ізомери неможливо:
К. інверсія
Саме тому алкіламіни не виявляють оптичної активності. ХІМІЧНІ ВЛАСТИВОСТІ Реакційна здатність алкіламінів визначається головним чином наявністю при атомі Нітрогену неподіленої пари електронів. За рахунок пари електронів атома Нітрогену аміни, з одного боку, здатні приєднувати протон від кислоти, виявляючи при цьому основні властивості, а з іншого — можуть атакувати в молекулі реагенту електрофільний центр (частіше атом Карбону, який несе частковий або повний позитивний заряд) і утворювати хімічний зв'язок з ним, виявляючи нуклеофільні властивості. Через порівняно низьку електронегативність атома Нітрогену та +I-ефекту з боку алкільних груп поляризованість зв'язку N—H в алкіламінах невелика. Тому первинні і вторинні алкіламіни дуже слабкі NH-кислоти. ОСНОВНІСТЬ Будучи похідними амоніаку, алкіламіни, подібно до амоніаку, виявляють яскраво виражені основні властивості, зумовлені наявністю на атомі Нітрогену неподіленої пари електронів. Причому алкіламіни сильніші основи, ніж амоніак. як відомо, сила основи визначається стійкістю катіона, який утворюється внаслідок приєднання протона. Чим стійкіший катіон, тим сильніша основа. На стійкість катіона впливає електронна природа замісників при катіонному центрі і природа розчинника. Алкільні замісники, виявляючи +I-ефект, сприяють де-локалізації позитивного заряду катіона і тим самим підвищують його стійкість. Тому можна припустити, що третинні алкіламіни, маючи три електронодонорні замісники, є сильнішими основами, ніж вторинні, а вторинні, у свою чергу, більш сильними, ніж первинні аміни та амоніак: < у**—н < Основність амінів (у газовій фазі)
Глава 20 286 Г Здатність до сольватації алкіламонієвих катіонів зростає в ряду: /Н Н\ /Н К' К" Я' Н'*Оч .О*"!! Н'*Оч N н < N Й<М N 5 к н-о' к н—о^ к н—о' н н н як бачимо, електронні ефекти замісників і сольватаційний ефект розчинника здійснюють на основність протилежний вплив. Тому внаслідок сумісного виявлення цих двох факторів у водних розчинах основність третинних амінів зазвичай нижча за основність первинних і вторинних: К' К к—^ < к —мн2 < ^н К" К' третинний первинний вторинний Основність амінів (у водних розчинах)
К— №і2 + НОН —- К—Анз + ОН" З кислотами алкіламіни утворюють солі алкіламонію: с2н5—кн2 + на —*- [с2н5— етиламоній хлорид При дії на амонієву сіль сильної основи — натрій гідроксиду вивільнюється вихідний амін: [С2Н5— ІЇН3]СГ + ИаОН --------- *► С2Н5—МН2 + ШСІ + НОН Реакцію солеутворення з подальшим виділенням вільного аміну часто використовують для очищення амінів.
Поиск по сайту: |
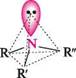


 Така закономірність зміни основності алкіламінів спостерігається в газовій фазі та в неводних розчинах. Однак у водних розчинах, поряд з електронними ефектами замісників, на стійкість катіона впливає сольватаційний ефект розчинника. Ступінь сольватації катіона тим вищий, чим менший його об'єм і нижчий ступінь делокалізації в ньому заряду.
Така закономірність зміни основності алкіламінів спостерігається в газовій фазі та в неводних розчинах. Однак у водних розчинах, поряд з електронними ефектами замісників, на стійкість катіона впливає сольватаційний ефект розчинника. Ступінь сольватації катіона тим вищий, чим менший його об'єм і нижчий ступінь делокалізації в ньому заряду.