 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Фізичні характеристики ариламінів
Сполука Назва Температура, °С
Анілін -6
N - Метиланілін -57
СН, N,N-Диметиланілін 2,5
11V N,N-Діетил анілін -21,3
о-Толуїдин -24
м-Толуїдин -32
Для ариламінів характерні реакції за участі аміногрупи і реакції за участі атомів Карбону ароматичного ядра. РЕАКЦІЇ ЗА УЧАСТІ АМІНОГРУПИ Ариламіни по атому Нітрогену вступають практично в усі реакції, розглянуті раніше для алкіламінів, проте перебіг деяких з них має свої особливості. Основність. За рахунок наявності неподіленої пари електронів на атомі Нітрогену ариламіни, як і алкіламіни, виявляють основні властивості. Однак основність ариламінів значно нижча за основність алкіламінів:
Основа СН3— 10,6 4,6 Глава 20
Т ^\„ з алкіламінами зумовлено кон'югацією неподіленої пари 2 +м-ефект електронів атома Нітрогену з я-електронною системою ароматичного ядра. Завдяки кон'югації неподілена пара електронів частково делокалізується по ароматичному ядру, і тому вона стає менш доступною для координації з протоном. На основність ариламінів істотно впливають замісники в бензеновому кільці. електронодонорні замісники збільшують основність, а електроноакцептор-ні — зменшують її. Анілін сильніша основа, ніж п-нітроанілін, але слабша, ніж п-анізидин:
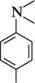
> > Основність ариламінів значно знижується при переході від первинних до третинних:
дифеніламін Основність ариламінів трифеніламін
+ с6н5— анілін анілінш хлорид реакція алкілювання.Подібно до алкіламінів, первинні і вторинні ариламіни реагують з галогеналканами, утворюючи N-алкіл- і N,N-діалкілариламіни. Через зниження нуклеофільних властивостей атома Нітрогену алкілювання ариламінів відбувається важче порівняно з алкіламінами:
*- С6Н5—№1— С2Н5 + НІ ІЧ-етиланілін с6н5—кн—с2н5 с2н5— .С2Н5
с6н5-< + НІ Реакцію алкілювання використовують для добування змішаних амінів. АмІни реакція ацилювання.При дії на первинні і вторинні ариламіни галогенангідри-дів або ангідридів карбонових кислот атоми Гідрогену аміногрупи заміщуються на ацильні залишки К— Сч .У результаті реакції утворюються заміщені аміди карбонових кислот. N-Ацильні похідні аніліну та його гомологів називають анілідами: О
(сн3со)2о —^ с6н5-нн-с-сн3 + оцтовий феніламід оцтової кислоти; ангідрид ацетанілід Колись ацетанілід за назвою «антифебрин» (від лат. anti — проти іfebris — гарячка, пропасниця) використовувався в медицині як жарознижуючий засіб. Аміди карбонових кислот легко гідролізуються в кислому або лужному середовищі з утворенням вихідного аміну і карбонової кислоти:
н+ —с —сн3 ІЛІ ацетанілід На цій властивості амідів карбонових кислот ґрунтується використання реакції ацилювання амінів для тимчасового захисту аміногрупи від окиснення та інших реакцій, якщо вони небажані. У N-ацильних похідних ароматичних амінів неподілена пара електронів атома Нітрогену знаходиться в сполученні не тільки з я-електронною системою бензе- нового ядра, але і з я-електронами подвійного зв'язку карбонільної групи С , О, що призводить до значного зниження порівняно з амінами її електронодонорних властивостей відносно бензенового кільця:
Взаємодія з нітритною кислотою.Первинні, вторинні і третинні ароматичні аміни при взаємодії з нітритною кислотою утворюють різні продукти. При дії нітрит-ної кислоти на первинні ароматичні аміни в присутності сильної мінеральної кислоти утворюються солі діазонію. ця реакція отримала назву «реакція діазотування». С6Н5— НО—N=0 НС1 (надлиш.) [С6Н5—N=N101 + 2Н2О бензендіазоній хлорид
Про умови перебігу і механізм реакції діазотування див. на с. 304. Вторинні ариламіни і N-алкілариламіни при взаємодії з нітритною кислотою, так як і алкіламіни, утворюють N-нітрозаміни:
с6н5-кн-с6н5 дифеніламін С6Н5—КН—СН3+ НО—N=0 1Ч-метиланілін N=0 >і-нітрозодифеніламш с6н5-к-сн3 N=0 К-метил->(-нітрозоанілін н2о Глава 20 Третинні N,N-діалкілариламіни під час дії нітритної кислоти піддаються нітро-зуванню в пара-положенні бензенового кільця, а якщо воно зайняте, то в орто-положенні:
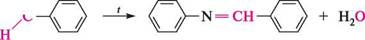
+ НО—N=0 N=0 4-нітрозо-К,І^-диметиланілш Ізонітрильна реакція.Аналогічно алкіламінам первинні ароматичні аміни при нагріванні з хлороформом і лугом у спиртовому середовищі утворюють ізонітрили (ізоціаніди) — речовини з різким неприємним нудотним запахом: С6Н5— СНС13 С2Н5ОН С6Н5— N = С ~ + + ЗН2О Фенілізоціанід Про механізм реакції див. на с. 289. Утворення азометинів.Первинні аміни при взаємодії з альдегідами і кетонами утворюють N-заміщені іміни (азометини)1. к— Амін
о=с Алвдегщ або кетон І^-заміщений імін; азометин + Н20 Іміни, отримані на основі аліфатичних карбонільних сполук і аліфатичних амінів, зазвичай малостійкі і спонтанно полімеризуються. Іміни, синтезовані з ароматичних амінів або ароматичних оксосполук, відрізняються значною стабільністю. Реакція первинних ароматичних амінів з ароматичними альдегідами була відкрита 1864 року італійським хіміком Хуго йозефом шиффом, тому продукти реакції називають основами Шиффа.
Під дією розведених кислот N-заміщені іміни гідролізуються з утворенням вихідного аміну і карбонільної сполуки. шиффові основи використовують у синтезі вторинних амінів, гетероциклічних сполук (похідних піридину, хіноліну), для захисту альдегідної групи або аміногрупи, а також в аналітичних цілях для ідентифікації первинних амінів і альдегідів. РЕАКЦІЇ ЗА УЧАСТІ АРОМАТИЧНОГО ЯДРА Для ариламінів характерні реакції електрофільного заміщення по ароматичному ядру, властиві ароматичним вуглеводням. Аміногрупа в молекулі ариламіну за
=К у ли, де R и R' = H, АмІни
рахунок виявлення +М-ефекту виступає як сильний електронодонорний замісник для бензенового кільця і тим самим активізує його реакційну здатність у реакціях електро-фільного заміщення. Тому ариламіни вступають у реакції електрофільного заміщення значно легше, ніж бензен. Аміногрупа, будучи замісником I роду, направляє електрофільне заміщення в орто- і пара-положення.
+ ЗНВг
Хуго Йозеф ШИФФ (1834-1915) Італійський хімік. Основні наукові праці присвячені органічної хімії. Одержав (1857) тіонілхлорид. Відкрив (1864) продукти конденсації альдегідів з амінами, пізніше названі основами Шиффа. Запропонував (1866) якісну реакцію на альдегіди з фуксинсуль-фітною кислотою (реакція Шиффа), а також на фурфурол. Створив прилад для визначення азоту за способом, запропонованим (1830) Ж. Б. Дюма.
N11, (СН3СО)2О ацетанілід
Вг 4-бромацетанілід Н2О; Н+
Вг 4-броманілін нітрування.Нітрування ариламінів на відміну від аренів має низку особливостей. Пряме нітрування ароматичних амінів концентрованою нітратною кислотою здійснити неможливо, тому що вони легко окиснюються. При використанні нітруючої суміші як нітруючого реагенту ариламіни, поряд з окисними процесами, які частково перебігають, перетворюються в ариламонійні солі. Амонійна група, будучи електроноакцепторним замісником, утруднює нітрування і сприяє утворенню переважно мета-і Глава 20
Н28О4
аніліній гідросульфат л«-нітроаніліній гідросульфат л-штроанілш Для захисту аміногрупи від процесів окиснення і протонування по атому Нітрогену ароматичні аміни попередньо ацетилюють. N-Ацетильні похідні, на відміну від амінів, дуже слабкі основи і навіть у сильнокислому середовищу реагують у непротонованій формі. Разом з тим N-ацетиламіногрупа зберігає електронодо-норні властивості та орієнтує нітрування в орто- і пара-положення. Співвідношення орто- і пара-ізомерів залежить від складу нітруючої суміші та умов проведення реакції. Після нітрування N-ацильні похідні гідролізують у кислому або лужному середовищі:
(СН3СО)2О -сн,соон
1ЧНС0СН, НЇ<ГО3; Н28О4
ацетанілід НОН; Н+. -СН3СООН о-нітроацетанілід о-нітроанілін N11,
НОН; Н+ -СН3СООН
N0, N0,
п -нітроацетанілід л-штроанілш Сульфування. При нагріванні аніліну з концентрованою сульфатною кислотою в середовищі висококиплячого розчинника утворюється п-амінобензен-сульфокислота, яку частіше називають сульфаніловою кислотою. Реакція перебігає через стадію утворення N-фенілсульфамінової кислоти, яка перегруповується в п-амінобензенсульфокислоту:
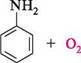
N11, Н28О4 (конц.) аніліній гідросульфат перегрупування 8О3Н л-амінобензен- сульфокислота; сульфанілова кислота Сульфанілова кислота є структурним фрагментом великої групи лікарських препаратів — сульфаніламідів (див. с. 510) АмІни ОКИСНЕННЯ АРИЛАМІНІВ У присутності кисню повітря анілін окиснюється до п-хіноніміну, набуваючи при цьому бурого забарвлення:
+ Н20 о Й-ХІНОНІМІН Під дією таких окисників, як монопероксисульфатна кислота H2SO5 (кислота Каро) або гідроген пероксид в оцтовій кислоті, первинні ароматичні аміни окис-нюються до нітрозосполук. При окисненні трифлуоропероксиоцтовою кислотою утворюються нітросполуки:
Нітрозобензен Нітробензен ДІАМІНИ Діамінами називають сполуки, які містять у своєму складі дві аміногрупи, зв 'язані з вуглеводневим радикалом. Залежно від природи вуглеводневого радикала розрізняють аліфатичні та ароматичні діаміни1: сн3—сн—сн2 Пропандіамін
Поиск по сайту: |

 плавлення
плавлення -гга,
-гга, —сн,
—сн,
 ,с,н<
,с,н< Дифеніламін
Дифеніламін Трифеніламін
Трифеніламін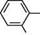 СН,
СН, СН,
СН, п-Толуїдин
п-Толуїдин 20.3.3. ХІМІЧНІ ВЛАСТИВОСТІ
20.3.3. ХІМІЧНІ ВЛАСТИВОСТІ

 Значне зниження основності ариламінів порівняно
Значне зниження основності ариламінів порівняно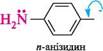








 Завдяки електроноакцепторним властивостям трьох бензенових кілець три-феніламін практично не має основних властивостей. Будучи слабкими основами, ариламіни утворюють солі лише із сильними мінеральними кислотами:
Завдяки електроноакцепторним властивостям трьох бензенових кілець три-феніламін практично не має основних властивостей. Будучи слабкими основами, ариламіни утворюють солі лише із сильними мінеральними кислотами:


 N11, +
N11, + 1 До азометинів належать органічні сполуки загальної формули
1 До азометинів належать органічні сполуки загальної формули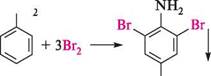 Галогенування.Анілін легко реагує з галогенами (Cl2, Br2) за відсутності каталізатора, утворюючи 2,4,6-тригалогенопохідні ариламіни. Так, при обробці аніліну бромною водою практично з кількісним виходом утворюється осад 2,4,6-триброманіліну:
Галогенування.Анілін легко реагує з галогенами (Cl2, Br2) за відсутності каталізатора, утворюючи 2,4,6-тригалогенопохідні ариламіни. Так, при обробці аніліну бромною водою практично з кількісним виходом утворюється осад 2,4,6-триброманіліну:


 N11,
N11,

 N11,,
N11,,
 -Н,0
-Н,0





 ІЧН
ІЧН