 |
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Салазопіридазин салазодиметоксин
Дослідження азобарвника пронтозилу привели до створення хіміотерапевтичних антибактеріальних препаратів широкого спектра дії — сульфаніламідів (див. с. 508—510). У 1935 році співробітники інституту луї Пастера встановили, що пронтозил в організмі розщеплюється з утворенням п-амінобензенсульфаміду. цей факт і змусив сконцентрувати увагу вчених на дослідженнях у ряду сульфаніламідів.
8О2ІЧН2 ОСНОВНІ ПОЛОЖЕННЯ ТЕОРІЇ КОЛЬОРОВОСТІ. АЗОБАРВНИКИ Теорія кольоровості розглядає залежність забарвлення органічних сполук від будови їх молекул. Забарвлення будь-якої речовини зумовлене її здатністю поглинати електромагнітне випромінювання у видимій ділянці спектра (400—760 нм). При цьому людське око сприймає предмет забарвленим у додатковий колір до того, що поглинається (табл. 21.1). Таблиця 21.1 Спектральні і додаткові кольори
Поглинання речовиною світла у вузькому діапазоні довжин хвиль приводить до появи яскравих барв (червоної, синьої, зеленої тощо). якщо речовина поглинає світло в широкому діапазоні видимої ділянки спектра, з'являються неяскраві барви (коричнева, бордо, хакі і т. ін.). При поглинанні речовиною практично всієї Глава 21 видимої ділянки спектра з'являється чорне або сіре забарвлення. Речовини, які не поглинають випромінювання у видимій ділянці, безбарвні. енергія, яку поглинає молекула у видимій ділянці, витрачається на збудження електронів (я-електронів), що утворюють я-зв'язки, та неподілених електронів (n-електронів), які при цьому переходять на більш високоенергетичні антизв'язуючі я*-МО (див. розд. 7.2.1). Таким чином, поглинання у видимій ділянці і пов'язана з ним поява забарвлення зумовлені я—►я*- і n-я*-переходами. Особливо легко здійснюється я—►я*-переходи в кон'югованій системі кратних зв'язків. Структурні фрагменти молекули, які поглинають випромінювання у видимій ділянці, і, за хромофорною теорією німецького хіміка Отто Ніколауса Вітта (1876), відповідальні за забарвлення, отримали назву «хромофори» (від грец. хромос — колір і форос — носій).
N=N—, хіноїдна група
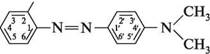
па —N тощо. Для появи забарвлення часто достатньо лише одного такого хромофора. якщо молекула містить кілька хромофорів, уключених в єдиний ланцюг кон'югації, інтенсивність забарвлення збільшується. Однак для того щоб речовина стала барвником, в її структурі мають бути присутніми угруповання, які без хромофорів не здатні викликати забарвлення, але, знаходячись з ними в єдиній кон'югованій системі, підсилюють забарвлення. Такі групи отримали назву «ауксохроми» (від грец. ауксео — збільшую і хромос — колір). Основні ауксохромы: групи —OH, —NH2, —NHR, —NR2, —OR, —SH тощо. Ауксохромами звичайно є замісники, які виявляють +М-ефект. Ауксохромні групи не тільки посилюють колір барвника, але і сприяють його взаємодії з матеріалом, який фарбується, що підвищує стійкість забарвлення до дії мийних засобів. За хімічною будовою розрізняють нітро-, нітрозо-, азо-, трифенілметанові, антрахінонові, індигоїдні барвники і т. ін. Найрозповсюдженішим класом барвників є азобарвники. їх використовують для фарбування вовняних і штучних тканин, шкіри, паперу і т. д. Колір деяких азобарвників змінюється залежно від рН середовища, що дозволяє використовувати їх як індикатори. Типовим азобарвником є індикатор метиловий оранжевий (метилоранж, геліантин).
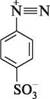
метиловий оранжевий; геліантин Метилоранж одержують азосполученням діазотованої сульфанілової кислоти з N,N-диметиланіліном:
-Н,0 ; 2НС1 -2Н2О* -М(СН3)2
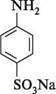
сульфанілова кислота натрієва сіль сульфанілової кислоти 4-діазобензен-сульфокислота ДІаЗО- та аЗОСПОЛУКи
-сн3соон метиловий оранжевий (червона форма)
метиловий оранжевий (жовта форма) У нейтральному і лужному середовищах метилоранж має жовте забарвлення, у кислому жовтий колір змінюється на червоний унаслідок утворення хіноїдної структури:
№О38 червона форма Жовте забарвлення метилоранжу в нейтральному і лужному середовищах зумовлене наявністю в його структурі довгої кон'югованої системи, до складу якої входить хромофор — азогрупа —N=N—. У кислому середовищі внаслідок приєднання протона до одного з атомів Нітрогену азогрупи відбувається електронна перебудова кон'югованої системи, при якій азогрупа зникає, але з'являється сильніша хромофорна група — хіноїдна. це приводить до поглиблення забарвлення. Інтервал переходу забарвлення від червоного до жовтого знаходиться в діапазоні pН середовища від 3,1 до 4,4. Як кислотно-основний індикатор використовують також азобарвник — метиловий червоний. соон
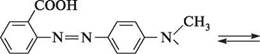
метиловий червоний; 4' -диметиламіноазобензен-2-карбонова кислота У лужному середовищі метиловий червоний знаходиться у вигляді азоформи, яка має жовте забарвлення, а в кислому — переходить у хіноїдну форму з червоним забарвленням:
ЧСН3 -он |^/ ^ \=/ ^ С1 жовта форма червона форма Інтервал переходу від червоного до жовтого забарвлення знаходиться в межах pН = 4,2...6,2. Глава 22 ГІДРОКСИЛЬНІ ПОХІДНІ ВУГЛЕВОДНІВ. ЕТЕРИ Гідроксильними похідними називають похідні вуглеводнів, в яких один або кілька атомів Гідрогену заміщені на гідроксильну групу. Залежно від типу гібридизації атома Карбону, безпосередньо зв'язаного з гідроксильною групою, гідроксильні похідні вуглеводнів поділяють на спирти (гідроксильна група знаходиться при атомі Карбону в sp3 -гібридизації) і феноли (гідроксильна група розташована при sp2-гібридизованому атомі Карбону, що входить в ароматичну систему). Сполуки з гідроксильною групою при sp2-гібридизованому атомі Карбону, що не входить в ароматичну систему, отримали назву «еноли». Такі речовини здебільшого нестійкі. Гідроксильні похідні з групою —ОН при атомі Карбону в sp-гібридизації невідомі. Залежно від кількості гідроксильних груп у молекулі розрізняють одно-, двох-, трьох- і поліатомні спирти і феноли. За розташуванням гідроксильної групи у вуглецевому ланцюзі спирти класифікують на первинні (група —ОН при первинному атомі Карбону), вторинні (група —ОН при вторинному) і третинні (група —ОН при третинному): К к\ ' к—сн,—он )сн—он к-с-он 2 кх І к
Поиск по сайту: |
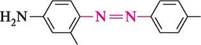
 Основні хромофори: досить довга кон'югована система кратних зв'язків, азогру-
Основні хромофори: досить довга кон'югована система кратних зв'язків, азогру-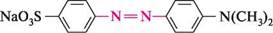

 рН = 3...4
рН = 3...4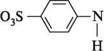

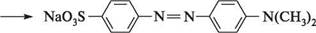

 соон
соон