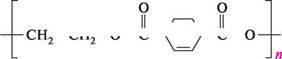|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
СПОСОБИ ДОБУВАННЯ ДВОХ-, ТРЬОХ- І ПОЛІАТОМНИХ СПИРТІВ
Гідроксильні похідні вуглеводнів з кількома гідроксильними групами можна добути тими ж способами, що й одноатомні спирти, використовуючи як вихідні речовини поліфункціональні похідні (див. розд. 22.1.3.). Так, гідролізом дигалоге-нопохідних вуглеводнів, які містять атоми галогенів при різних атомах Карбону, добувають гліколі: Гтт_ Гтт_ Гтт 2№ОН (Н2О) Гтт_Гтт_ СН2 СН2 СН2^^ >■ СН2 СН2 Вг Вг ОН ОН 1,3-дибромопропан 1,3-пропандіол Крім того, існує низка специфічних способів добування. Окиснення (гідроксилювання) алкенів.цю реакцію проводять, діючи на алкени водним розчином калій перманганату на холоді (реакція Вагнера): ЗСН3—СН=СН2 + 2КМпО4 + 4Н2О —► ЗСН3—СН—СН2 + 2К0Н + 2МпО2 ОН ОН пропен 1,2-пропандіол Гідратація оксиранів.Оксиран і його похідні приєднують молекулу води, утворюючи а-гліколі. Реакція відбувається в кислому середовищі і супроводжується розкриттям циклу: н2с-сн2 + н2о -*+ сн2-сн2 оксиран 1,2-етандіол цей спосіб застосовується в промисловості для виробництва етиленгліколю. Кислотним або лужним гідролізом жирів (естерів гліцерину і вищих гомологів карбонових кислот) можна одержати найбільш важливий представник триолів — гліцерин (1,2,3-пропантриол, гліцерол): сн2— о—со—к сн2— он сн—о—со—к сн2— о—со—к сн2— он тригліцерид (жир) гліцерин карбонова кислота Глава 22
сн сн2 пропілен сн2—сі _№ЮН_
алілхлорид
СН2—ОН ■>- СН—ОН (С12 + Н2О) сн2—сі 3-хлор-1,2-пропандіол -ШС1 сн2— он сн—он сн2—он гліцерин 22.2.2. ФІЗИЧНІ ВЛАСТИВОСТІ Нижчі члени гомологічного ряду діолів — це в'язкі рідини, вищі — кристалічні речовини. Рідкі гліколі мають більшу густину і більш високі температури плавлення та кипіння, ніж одноатомні спирти; добре розчиняються у воді. Трьохатомні спирти — в'язкі рідини або тверді речовини, що важко кристалізуються. В'язкість, розчинність у воді, температури плавлення та кипіння гідроксильних похідних аліфатичних вуглеводнів збільшуються в ряду: одноатомні спирти < гліколі < гліцерини. Така залежність — наслідок посилення асоціації молекул за рахунок утворення міжмолекулярних водневих зв'язків. Відмінною рисою гідроксильних похідних вуглеводнів з кількома OH-групами є їх солодкуватий смак, який підсилюється, як правило, зі збільшенням кількості гідроксильних груп у молекулі. 22.2.3. ХІМІЧНІ ВЛАСТИВОСТІ Двохатомні спирти вступають у ті ж реакції, що й одноатомні, з тією лише різницею, що вони можуть проходити за участі однієї або двох гідроксильних груп. Ще більший вихід різноманітних продуктів можливий для реакцій за участі трьох- і поліатомних спиртів. Гліцерин утворює три ряди похідних: моно-, ди-і тризаміщені продукти. При цьому для моно- і дизаміщених похідних можливі структурні ізомери, що зумовлено різним положенням замісників.
Утворення алкоголятів. Гліколі — більш сильні OH-кислоти, ніж одноатомні спирти, тому вони утворюють алкоголяти (гліколяти) не тільки з лужними металами, але і з іншими активними металами (Al, Mg і т. ін.), а також з лугами і гідроксидами важких металів. Підвищення кислотних властивостей гліколів пов'язане з електроноакцепторним впливом однієї гідроксильної групи на іншу (-I-ефект). При взаємодії з активними металами безводні гліколі утворюють неповні і повні гліколяти: сн2— ош сн2— он
натрій моногліколят а-Гліколі реагують з купрум(II) гідроксидом з утворенням купрум(II) гліколя-ту — комплексної сполуки синього кольору: ГІДрОКСиЛЬнІ ПОхІДнІ ВУГЛеВОДнІВ.етери
Зі збільшенням кількості гідроксильних груп у молекулі кислотні властивості сполуки посилюються. Так, гліцерин порівняно з етиленгліколем має більш виражені кислотні властивості. У водному розчині лугу гліцерин легко утворює моногліцерати [HOCH2—CH(ONa)—CH2OH]. При взаємодії з купрум(II) гідроксидом гліцерин утворює купрум(II) гліцерат (розчин синього кольору). Висока розчинність гліцератів у воді пояснюється їх комплексною будовою: н2с—он н2с—он 2НС—ОН+ ІСи(ОН)2 Н2С—ОН Н2С— О* ^О—СН ІЧаІ но—сн2 Взаємодіяз галогеноводнями.При взаємодії гліколів з галогеноводнями (HCl або HBr) утворюються хлоро- або бромогідрини: _н2о* Друга гідроксильна група заміщується важче (краще використовувати PCl5 або SOCl2): ■ сн2—сн2 ОН ОН СІ СІ При взаємодії гліцерину з галогеноводнями утворюється суміш моно- і дига-логенозаміщених продуктів: НС1 1-їП сн2— сн—сн2 ОН ОНОН СІ ОН ОНСІ ОН СІ гліцерин гліцерин гліцерин монохлорогідрин дихпорогідрин Утворення етерів і естерів.При взаємодії гліколів зі спиртами, мінеральними або органічними кислотами утворюються два ряди похідних: а) неповні і повні етери СН2—ОН к-он; н+ СН2—О—К к-он;н+ СН2—О—К
б) неповні і повні естери нож>2 СН2— ОН СН2—О— СН2— ОН НОЇТО2 -Н20 Глава 22 СН2—О— СН2—О—N02
етиленгліколь мононітрат етиленгліколь динітрат
СН2 ОН но—с—к;н+ СН2—ОН О о СН2— О С К НО —С—К;Н+
О СН2—О—С—К О СН,,—О—С—К
Для гліцерину в цьому випадку утворюються три ряди похідних. При взаємодії гліцерину з концентрованою нітратною кислотою в присутності концентрованої сульфатної кислоти одержують повний естер гліцерину — гліцерин тринітрат (нітрогліцерин): сн2—он
Н28О4 (конц.) СН—ОН+ ЗНО—N02(конц.) СН2—ОН Аналогічно за жорстких умов утворюється повний естер гліцерину — гліцерил-триацетат: О
сн2—он сн—он + зно—с—сн, сн2— он ється суміш продуктів окиснення: н+ сн2—о—с—сн3 о сн—о—с—сн3 + зн2о о
сн2—он сн2—он етиленгліколь сн2—он гліколевий альдегід [ ] ^о ?^он _ сн2— он гліколева кислота ^о н н [О], ОН]оі н гшоксилова кислота он он щавлева кислота ГІДрОКСиЛЬнІ ПОхІДнІ ВУГЛеВОДнІВ. етери
Деякі з цих проміжних продуктів можна виділити, проводячи окиснення етиленгліколю за спеціально підібраних умов. Окиснення гліцерину проходить складно, багатоступінчасто. Залежно від природи окисника можуть переважати ті або інші продукти окиснення. На першому етапі окиснення утворюється гліцериновий альдегід або діоксиацетон, кінцевим продуктом є мезоксалева кислота:
Специфічною реакцією окиснення 1,2-діолів є їх взаємодія з перйодатною кислотою НIO4 (глікольне розщеплення). У процесі реакції відбувається розщеплення вуглець-вуглецевого зв'язку в діольному фрагменті — С — С—, при якому залеж- он он но від будови гліколю утворюються відповідні альдегіди і кетони: К Н +НЮ3 К—С —С— он он гліколь кетон У цю ж реакцію вступають і гліцерини: К к- он он он
2НЮ3 он
кетон мурашина кислота Дегідратація гідроксильних похідних з кількома групами Он.Під дією водовід-німаючих реагентів гліколі, як і одноатомні спирти, піддаються внутрішньомоле-кулярній або міжмолекулярній дегідратації. Напрям дегідратації залежить від умов проведення реакції. Так, при нагріванні етиленгліколю в присутності концентрованої сульфатної кислоти відбувається міжмолекулярна дегідратація, і утворюється циклічний простий діетер — діоксан: Н2С он но СН2 Н25О4;ґ діоксан СН2 СН2 Глава 22 Для 1,4- і 1,5-діолів можлива внутрішньомолекулярна дегідратація з утворенням п'яти- і шестичленних циклічних етерів: Н2С — СН2— СН2— СН2 н2804 нг9 ~~ ^Н2 он он "Н2°' н2с сн2 чох 1,4-бутандіол тетрагідрофуран Гліцерин при нагріванні з калій гідросульфатом або іншими водовіднімаючими засобами піддається внутрішньомолекулярній дегідратації з утворенням ненасиче-ного альдегіду — акролеїну: СН,—СН—СН, кн8О4ч СН,—СН= | 2 | | 2 гліцерин нх-сн-с І акролеїн Акролеїн (акриловий альдегід) — це рідина з різким подразнюючим запахом. Поліконденсація двохатомних спиртів.Молекули етиленгліколю в кислому середовищі вступають у реакцію поліконденсації з утворенням поліетеру — по-ліетил енгліколю: но—сн2—сн2—он + но—сн2—сн2—он
но—сн2—сн2—о—сн2—сн2—он діетиленгліколь —► ноч-сн2— сн2— поліетиленгліколь Поліетиленгліколь з молекулярною масою до 400 використовують у фармації як розчинник лікарських речовин, основи для мазей, а також як зв'язуюча речовина у виробництві таблеток. Поліконденсація етиленгліколю в лужному середовищі приводить до утворення краун-етерів (див. с. 366). к+
[18]-краун-6 ГІДрОКСиЛЬнІ ПОхІДнІ ВУГЛеВОДнІВ.етери
•Р "І Г комплекс [К(18-краун-6)]+ Важливою властивістю краун-етерів є здатність утворювати стійкі ліпофільні комплекси з катіонами лужних і лужноземельних металів. Вони використовуються для поліпшення розчинності неорганічних солей в органічних розчинниках, як міжфазні каталізатори, екстрагенти, як лікарські препарати, антидоти, пестициди і т. д. При поліконденсації етиленгліколю з терефталевою кислотою утворюється поліестер — поліетилентерефталат, який використовують для виготовлення синтетичного волокна — лавсану:
сн2—он сн2—он етиленгліколь „
но ч=/ он терефталева кислота -лН2О
поліетилентерефталат
Поиск по сайту: |
 СН3
СН3 -ИаСІ
-ИаСІ СН2—ОН "Н2°
СН2—ОН "Н2° он он о
он он о