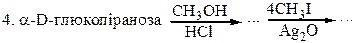|
|
|
Архитектура Астрономия Аудит Биология Ботаника Бухгалтерский учёт Войное дело Генетика География Геология Дизайн Искусство История Кино Кулинария Культура Литература Математика Медицина Металлургия Мифология Музыка Психология Религия Спорт Строительство Техника Транспорт Туризм Усадьба Физика Фотография Химия Экология Электричество Электроника Энергетика |
Мета роботи: Вивчити хімічні властивості вуглеводів. ⇐ ПредыдущаяСтр 9 из 9
Тривалість виконання:4 год.
Теоретична частина
При вивченні вуглеводів необхідно відрізняти за хімічними властивостями глюкозу від фруктози, моносахариди від ди- і полісахаридів. До найважливіших властивостей вуглеводів відносяться перетворення, що пов,язані з наявністю у молекулах карбонільної та гідроксильних груп, а також їхня стереоізомерія (α- і β-аномери і їх перетворення, явище мутаротації). Наявність глікозидного гідроксилу у дисахаридах визначає їх віднесення до відновлюючих (є глікозидний гідроксил, існує рівновага з відкритою формою) чи невідновлюючих (немає глікозидного гідроксилу) дисахаридів. Відновлюючі дисахариди є відновниками. Невідновлюючі дисахариди (наприклад, сахароза) не проявляють таких властивостей. Основні представники полісахаридів - це крохмаль (побудований із залишків α-D-глюкози) резервний полісахарид рослин та целюлоза (клітковина), побудована із залишків β-D-глюкози, і є будівельним матеріалом рослин [1, c.507-536].
Експериментальна частина
Дослід 1. Утворення срібного дзеркала У чисту пробірку наливають 2 мл водного розчину лугу і обережно нагрівають (доводять до кипіння). Потім виливать цей розчин, пробірку ополіскують дистильованою водою і наливають 2-3 мл 1 %-го розчину AgNO3, далі додають краплями 5 %-й розчин аміаку, щоб осад, який ут-ворився спочатку, зник. До утвореного амонійного розчину оксиду срібла додають 2 мл розчину глюкози. Пробірку обережно підігрівають
Спостереження:
Рівняння реакції:
Дослід 2. Реакція глюкози реактивом Фелінга Готують реактив Фелінга, змішуючи рівні об’єми розчину сульфату міді( ІІ) (розчин 1) та лужного розчину сегнетової солі (розчин 2). Розчин має характерне синє забарвлення. У пробірку з 2-3 мл свіжоприготованого реактиву Фелінга додають 2 мл 1 %-го розчину глюкози. Реакційну суміш обережно нагрівають.
Спостереження:
Рівняння реакції:
Дослід 3. Відношення сахарози до реактиву Фелінга У пробірку наливають 2 мл реактиву Фелінга і додають такий же об’єм 2 %-го розчину сахарози. Нагрівають.
Спостереження:
Дослід 4. Гідроліз сахарози У пробірку наливають 4 мл 2 %-го розчину сахарози, додають кілька крапель сірчаної кислоти, кидають шматочки невипаленої порцеляни (цен-три кипіння) і кип’ятять 3-5 хвилин. Реакційну суміш охолоджують та ней-тралізують розчином лугу до слабколужної реакції, додають 4 мл реактиву Фелінга. Нагрівають.
Спостереження:
Рівняння реакцій:
Дослід 5. Розчинення клітковини у мідно-амонійному розчині реактиву Швейцера Наливають в пробірку 4-5 мл розчину мідно-амонійного комплексу, занурюють у розчин смужку фільтрувального паперу або шматочок вати, перемішують скляною паличкою. При розчиненні клітковини утворюється в’язкий розчин. Виливають частину отриманого розчину в склянку з 10 мл 20 %-ої соляної кислоти. Що при цьому відбувається?
Спостереження:
Дослід 6. Приготування рослинного пергаменту Смужку фільтрувального паперу занурюють на кілька секунд у хо-лодну 80 %-у сірчану кислоту. Папір швидко промивають водою, нейт-ралізують кислоту водним розчином аміаку, висушують. Які зміни відбу-лися з фільтрованим папером?
Спостереження:
Висновок: Техніка безпеки
1. При попаданні водного розчину лугу на шкіру уражене місце промити великою кількістю води та нейтралізувати 1 %-им розчином оцтової кислоти. 2. Після проведення реакції срібного дзеркала (дослід 1) реакційну суміш, що міститься у пробірці, вилитити у спеціальний посуд. 3. Нагрівання розчину сахарози з концентрованою сірчаною кислотою проводити у захисних окулярах. 4. При попаданні кислоти на шкіру промити уражене місце великою кількістю води та нейтралізувати 1 %-им розчином гідрокарбонату натрію. 5. Дослід 5 проводити у витяжній шафі.
Контрольні запитання та завдання 1. Наведіть приклади аномерів та епімерів. 2. Що таке явище мутаротації ? 3. Які сполуки утворяться, якщо сахарозу піддати вичерпному метилюванню, а потім гідролізу? Наведіть рівняння реакцій. 4. Наведіть приклади відновлюючих і невідновлюючих дисахаридів. Вкажіть відмін-ності у їхній будові. За допомогою яких реакцій їх можна розпізнати? 5. Які дисахариди здатні до мутаротації? 6. За допомогою яких реакцій глюкозу можна перетворити на фруктозу?
Завдання до самостійної роботи Здійсніть перетворення:
Перетворити в декілька стадій: 1. Альдотетроза → кетопентоза. 2. Фруктоза → метилбутилоцтова кислота. 3. Глюкоза → енантова кислота. 4. D-глюкоза → D-фруктоза. 5. D-арабіноза → D-глюкоза. 6. D-глюкоза → D-арабіноза. 7. Целюлоза → віскоза.
Виконати завдання [2], № 8.1-3, 6, 8, 9, 12, 16, 18, 26-31, 34, 36-42).
Література 1.Ластухін Ю.О., Воронов С.А. Органічна хімія. Підручник для вищих навчальних закладів.-Львів; Центр Європи, 2001.-864 с. 2.Органічна хімія в прикладах і задачах:Навч.посібник / Е.В.Алісо-ва, Я.Б.Козліковський, Н.І.Кулик та ін.:За ред. О.Г. Юрченка.- К.: Вища шк., 1993.- 192 с. 3. Вопросы и задачи по органической химии: Учеб.пособие /:Т.К. Ве-селовская., И.В Мачинская., Н.М Пржиягловская и др.: Под ред. Н.Н.Суво-рова.- М.: Высш.шк., 1988. - 255 с. Зміст 1.Лабораторна робота 1. Якісний аналіз органічних сполук…………..4 2.Лабораторна робота 2. Методи добування та хімічні властивості алканів …………………………………………………………………...7 3.Лабораторна робота 3. Методи добування та властивості ненасичених вуглеводнів………………………………………………11 4.Лабораторна робота 4.Добування та хімічні властивості ацетиленових вуглеводнів……………………………………………..15 5. Лабораторна робота 5. Хімічні властивості алкілгалогенідів ...……19 6. Лабораторна робота 6. Хімічні властивості спиртів................. …….22 7. Лабораторна робота 7.Методи добування та хімічні властивості альдегідів і кетонів…………………………………...…. 26 8.Лабораторна робота 8. Методи добування та хімічні властивості карбонових кислот…………………………………….....30 9. Лабораторна робота 9. Методи добування та властивості амінів та α-амінокислот).. .....................................................................35 10. Лабораторна робота 10. Властивості вуглеводів…………………..40 Література .......................................................................................…...43
Поиск по сайту: |